Белки (белковые вещества)
Белки, белковые вещества, очень сложные органические соединения, вырабатываемые пока исключительно в живых организмах и, по-видимому, неразрывно связанные с процессом жизни. Они состоят из углерода, водорода, азота, серы и кислорода. Кроме того, в состав некоторых белков входят еще и другие элементы, как фосфор, железо, галоиды и проч., однако, в большинстве случаев эти элементы принадлежат к составу не самой белковой частицы, а тех веществ, которые соединены с белковым ядром. Процентное содержание названных элементов колеблется в следующих пределах: углерода - от 50 до 55, водорода - от 6 ½ -7 ½, азота - от 15-17, серы от 0,5 до 2%.
По своим физическим свойствам белковые вещества относятся к т. н. коллоидам. Типические свойства коллоидов проявляются в их растворах: именно, в растворах коллоидов растворенное вещество находится в состоянии меньшего разделения, чем в истинных растворах. В истинных растворах растворенное вещество разделено на отдельные химические молекулы, которые и распределяются равномерно по всему объему растворителя; в коллоидальных же растворах вещество распределено на частицы, хотя и очень мелкие, но превышающие размеры химических молекул. Поэтому, коллоидальные растворы не представляют собой, в сущности, истинных растворов, приближаясь по своим свойствам к т. н. суспензиям или взвесям. Примером последних может служить мутная вода, в которой взмучены мельчайшие частички глины. Вследствие такого строения коллоидального раствора, связь растворителя с растворенным телом очень слаба, или ее вовсе нет. Проявлением связи между растворителем и растворенным телом в обычных растворах можно считать, между прочим, - повышение температуры кипения и понижение точки замерзания. Так, все истинные растворы в воде кипят при t° выше 100° и замерзают при t° ниже 0°. Коллоиды и, в частности, белковые вещества не обнаруживают этого явления, их растворы кипят и замерзают при той же t°, как и чистый растворитель. Отсутствием связи между растворителем и растворенным телом объясняется, далее, способность коллоидов выделяться из растворов в виде осадка при самых ничтожных влияниях на коллоидальный раствор. Так, многие коллоиды и, между прочим, большинство белковых веществ выделяются в виде осадка при нагревании их растворов ниже точки кипения. Некоторые коллоиды выделяют «растворимое» вещество при переливании из одной пробирки в другую. Многие коллоиды самопроизвольно свертываются в том случае, если их растворы приготовлены на обыкновенной дистиллированной воде. Причиной свертывания в этом случае являются те ничтожные количества солей, которые содержатся в такой воде.
Отдельные частицы белка, взвешенные в белковом растворе, можно видеть при помощи т. н. ультрамикроскопа. Эти частицы часто удается отфильтровать от жидкости, только для этого нужно взять более плотный фильтр, например, производя фильтрацию при пониженном давлении через цилиндр из слабо обожженной глины, употребляемый для гальванических элементов. При такой фильтрации через фильтр проходит чистая вода, а частицы белковых веществ задерживаются фильтром.
Белковые вещества, подобно другим коллоидальным телам, известны в двух состояниях. Растворенное состояние белковых веществ носит название гидросоля; белковые вещества, выделенное из раствора в виде осадка, образует т. н. гидрогель, или гель. Почти всегда гидросоли очень легко переходят в гидрогели, обратный переход от геля к солю - не всегда бывает возможен. В этом случае гель называется необратимым; наоборот, обратимый гель, при соответствующих условиях, превращается в соль. Сверток белковых веществ, полученный при нагревании белкового раствора, принадлежит к необратимым гелям; наоборот, осадки белка, вызванные прибавкой солей, относятся к обратимым гелям. Наконец, известны такие осадки, которые в первое время после выделения являются обратимыми, а затем переходят в необратимые. Сюда принадлежит, между прочим, осадок, образующийся в растворах белковых веществ после прибавки спирта.
Грэм (Graham), впервые выделивший коллоиды, как особую группу веществ, относил к числу их признаков еще два: неспособность диффундировать через перепонки и отсутствие кристаллизации. Первый из этих признаков, действительно, наблюдается в случае белковых веществ и, по-видимому, стоить в связи с неспособностью белковых веществ давать истинные растворы, так как для диффузии через перепонки диффундирующее вещество должно растворяться в веществе перепонки. Отсутствие кристаллизации, наоборот, нельзя считать следствием общих свойств коллоидов, поэтому, в очень многих случаях, по крайней мере, у белковых веществ, этот признак отсутствует. Многие белковые вещества более или менее легко дают кристаллические осадки. Такие кристаллы белковых веществ нередко встречаются в природе, особенно в семенах некоторых растений, например тыквы, клещевины, а также в ядрах животных клеток. Такие же кристаллы могут быть получены и искусственно из белковых растворов, путем медленного осаждения, например, спиртом, солями и проч.
Известно, что для изучения органического вещества недостаточно знать процентный состав его из элементов; для этого, кроме того, необходимо определить молекулярный вес вещества. Для определения молекулярного веса существуют двоякого рода приемы - физические и химические. Физические способы определения молекулярного веса, основанные на определении плотности пара или понижения точки замерзания растворов, - неприменимы к белковым веществам, так как белковые вещества не могут быть превращены в пар без разложения, а их растворы носят коллоидальный характер, т. е. не дают понижения точки замерзания. Поэтому, для определения молекулярного веса белковых веществ приходится прибегать к химическому способу: мы предполагаем, что элемент, входящий в состав белковых веществ в наименьшем количестве, содержится в молекуле белкового вещества в числе одного атома, и затем вычисляем на основании процентного состава белковых веществ, какое число атомов других элементов должно входить в состав белковой частицы. Предполагая, что сера содержится в белке в количестве одного атома, можно вычислить следующие молекулярные веса для различных белковых веществ:
|
|
Содержание серы в %% |
Молекулярный вес |
|
Эдестин (кристаллы) |
0,87 |
3680 |
|
Оксигемоглобин (кр.) |
0,43 |
7440 |
|
Сывороточный альбумин (кр.) |
1,89 |
1700 |
|
Яичный альбумин (кр.) |
1,3 |
2460 |
|
Глобулин |
1,38 |
2320 |
Приведенные цифры показывают, что молекула белкового вещества гораздо больше молекул других органических соединений, другими словами, белковые вещества принадлежат к числу самых сложных органических веществ. Химическое строение таких сложных соединений изучается путем разложения их на вещества более простого состава. Этот же прием применяется и к белковым веществам. При кипячении белковых веществ с разведенными кислотами и щелочами, белковые вещества распадается на ряд веществ, иногда еще очень сложного, но, во всяком случае, определенного химического состава. Изучение этих продуктов распада белка, особенно в связи с попытками искусственного получения подобных белку тел из продуктов распада белка, дает возможность составить приблизительное понятие о строении белковой частицы.
Продукты распада белковых веществ все содержат азот и принадлежат к группе т. н. аминокислот. Большая часть аминокислот, получающихся при разложении белка, принадлежит к т. н. моноаминокислотам, т. е. содержат один остаток аммиака в своей частице; однако некоторые из продуктов расщепления белка относятся к ди- и полиаминокислотам, т. е. содержат в частице два или несколько остатков аммиака. Кислоты, от которых происходят эти аминокислоты, относятся либо к жирному, либо к ароматическому, либо к гетероциклическому ряду. До настоящего времени из продуктов распада белка выделены следующие аминокислоты:
I. Жирный ряд:
1. Гликоколь, или аминоуксусная кислота CH2(NH2СООН).
2. Аланин, или аминопропионовая кислота CH3CHNH2COOH.
3. Валин, или аминоизовалерьяновая кислота
![]()
4. Лейцин, или аминоизобутилуксусная кислота
![]()
5. Изолейцин, или аминометилэтилпропионовая кислота
![]()
6. Серин, или аминомолочная кислота СН2. (ОН). СН. (NH2)СООН.
7. Аспарагиновая, или аминоянтарная кислота СООН. СН(NH2). СН2. СООН.
8. Глютаминовая, или аминоглутаровая кислота СООН. CH(NH2). СН2. СН2. СООН.
9. Лизин, или диаминокапроновая кислота (NH2).СН2. СН2. СН2. СН2. CH.(NH2)COOH
10. Аргинин, или гуанидинаминовалерьяновая кислота
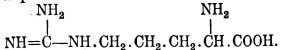
11. Цистин, представляющий собой соединение двух молекул цистеина, или аминотиомолочной кислоты СН2. SH. СН(NH2). СООН. Формула цистина соответствует выражению:
СООН . CH(NH2)CH2S—S . CH2(NH2)CH.COOH.
II. Ароматический ряд:
12. Фенилаланин, или фениламинопропионовая кислота С6Н5. СН2 . CH(NH2). СООН.
13. Тирозин, или оксифениламинопропионовая кислота С6Н4(OH)CH2CH(NH2)COOH.
III. Гетероциклические соединения:
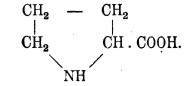
14. Пролин, или пирролидинкарбоновая кислота
15. Оксипролин, или оксипирролидинкарбоновая кислота, гидроксильное производное предыдущего вещества.
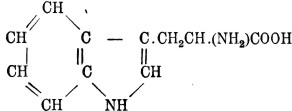
16. Триптофан, или индоламинопропионовая кислота
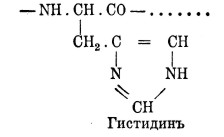
17. Гистидин, или имидазоламинопропионовая кислота
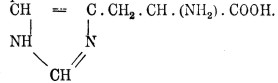
Соединение аминокислот друг с другом в белковой молекуле выясняется опытами Эмиля Фишера, которому удалось искусственно получить т. н. полипептиды, представляющие собой продукты соединений нескольких аминокислот и напоминающие некоторыми своими свойствами природные белковые вещества.
Строение этих соединений можно выяснить на простейшем примере, именно на т. н. глицилглицине, который представляет собой соединение двух молекул гликоколя, или глицина. Для получения глицилглицина действуют хлорангидридом монохлоруксусной кислоты на гликоколь по уравнению:
![]()
Обрабатывая полученный продукт аммиаком, получают глицилглицин:
![]()
Таким же путем можно присоединить к полученному соединению еще одну молекулу гликоколя и т. д.; в результате получается цепь аминокислот, которая может быть очень длинной; так, до настоящего времени удалось получить пептиды, содержание до 18 молекул аминокислот в составе своей частицы.
Представим себе полипептид, состоящий из сочетания одних только молекул гликоколя. Он может быть изображен в виде формулы:

Представим себе, далее, что водороды, вынесенные под строчку, замещены различными радикалами, входящими в состав разных аминокислот, образующихся при расщеплении белка. Мы получим формулу следующего вида:
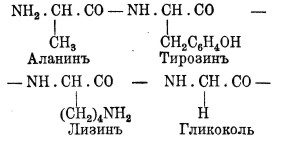
Эта формула дает понятие о строении белковой частицы. Последняя состоит из цепи групп - NH. СН. СО-, к которой подвешены радикалы различных аминокислот, входящих в состав белка.
В соответствии с указанным строением, белок дает ряд цветных реакций. Ни одна из этих реакций сама по себе не может служить доказательством белковой природы вещества, дающего эту реакцию, но если данное тело дает все цветные реакции белка, это тело нужно считать принадлежащим к белковым веществам. К цветным реакциям белка относятся следующие пробы.
1. Биуретовая реакция. С едким натром и медным купоросом раствор белка окрашивается в фиолетовый или красный цвет. Эту реакцию не дает ни один из продуктов расщепления белка, следовательно, она обусловлена теми атомными группировками, которые возникают при соединении аминокислот друг с другом. Действительно, биуретовую реакцию дают вещества, содержащие в составе своей молекулы группу атомов С-СО-NH, а такая именно группа возникает при соединении аминокислот друг с другом.
2. Ксантопротеиновая реакция. При кипячении белковых веществ с азотной кислотой получается лимонно-желтая окраска, переходящая после нейтрализации аммиаком в хромово-желтую. Эта реакция обусловлена образованием нитропродуктов. Известно, что нитропродукты образуются только из ароматических тел; другими словами, ксантопротеиновая реакция указывает на присутствие в белковом веществе бензольного кольца.
3. Реакция Адамкевича. При кипячении с концентрированной серной и ледяной уксусной кислотой белок окрашивается в красновато-фиолетовый цвет. Ту же самую реакцию дает триптофан.
4. Реакция Миллона. При кипячении белка с реактивом Миллона (раствор ртути в азотной кислоте) белок окрашивается в малиново-красный цвет. Эту же реакцию дает тирозин.
5. Свинцовая реакция. При кипячении белка с едким натром и какой-нибудь свинцовой солью получается черная окраска, вследствие образования сернистого свинца. Эту реакцию дает цистин.
Кроме цветных реакций белковые вещества дают ряд осадочных реакций. Их можно разделить на три категории. Первая - коллоидные реакции. Сюда относится, в сущности, только тепловое свертывание белка и, может быть, еще осаждение минеральными кислотами. Вторую категории составляют реакции, в которых прибавляется вещество, само по себе не осаждающее белка, но вещество это прибавляется в столь большом количестве, что совершенно меняется состав растворителя (воды), и получается жидкость, в которой белок просто нерастворим, хотя никакого химического соединения белка с реактивом при этом не происходит. К этой категории относится осаждение белка спиртом, солями и проч. Третью категорию осадочных реакций составляют реакции, в которых образуются нерастворимые соединения белка с реактивом. Сюда относятся: 1. Осаждение белка алкалоидными реактивами (танин, пикриновая, фосфорно-вольфрамовая, фосфорно-молибденовая кислота и проч.). 2. Осаждение белка солями тяжелых металлов, причем образуются нерастворимые соли белка.
В природе белковые вещества вырабатываются в живой клетке. Основным веществом протоплазмы клеток является белок. Всюду, где разыгрываются жизненные явления, мы встречаем то или иное белковое тело, поэтому белок считается химической основой жизни. Думали, что это биологическое значение белка объясняется просто его необыкновенно сложным составом и соединенной с этой сложностью подвижностью белковой частицы, с большой способностью к химическим превращениям. Однако, по-видимому, это не так. Само по себе белковое тело даже в состоянии водного раствора, находясь вне живой клетки, не подвергается тем непрерывным химическим изменениям, которые характеризуют жизненный процесс. Так например, белок куриного яйца может сохраняться годами без всякого изменения, если только к нему прекращен доступ живых бактерий. В то время, как белок живой протополазмы непрерывно окисляется на счет атмосферного кислорода, мертвый белок совершенно индифферентен к кислороду. Это различие некоторыми учеными сводится к различию химического строения белка; они предполагают, что в молекуле живого белка атомы элементов, входящих в его состав, связаны друг с другом иными связями, чем в молекуле мертвого белка. Нужно заметить, впрочем, что это есть чистая гипотеза, построенная специально для объяснения вышеуказанных различий между живым и мертвым белком и не подкрепленная никакими фактами. Кроме того, указанное различие может быть объяснено иначе и более правдоподобно - именно, присутствием в живом веществе особых активных тел (ферментов), вызывающих химические изменения, свойственные живому белку.
В составе тела животных и растений белки содержатся, главным образом, в виде солей. В таком состоянии они присутствуют в жидкостях организма, в таком же состоянии водного раствора белки входят, вероятно, и в состав живой протоплазмы клеток. Однако, в некоторых случаях белки организма образуют гели. Эти последние служат для построения плотных составных частей тела: перепонок, кутикулярных образований, волокон соединительной ткани и проч.
Классификация. Белковые вещества разделяются на три класса: истинные белки, протеиды, альбуминоиды. Истинными белками называются такие белковые вещества, молекула которых состоит исключительно из цепи атомов, характерных для строения белка, и не содержит никаких компонентов небелкового характера. Самыми известными представителями этого класса являются альбумины и глобулины. Они входят в состав жидкостей организма и его клеток. Альбумины отличаются от глобулинов по условиям растворимости. Именно, альбумины растворимы в чистой воде, наоборот, глобулины растворимы в воде только в присутствии солей, либо щелочей, либо кислот. Кроме того, при действии крепких растворов солей глобулины осаждаются раньше альбуминов. К этому же классу истинных белков относятся так называемые нуклеоальбумины, наиболее известным представителем которых является казеин молока. В состав нуклеоальбуминов входит фосфор, который, по всей вероятности, содержится не в самой белковой частице, а в небелковой, так называемой простетической группе, соединенной с белковым ядром. Наконец, к этому же классу относятся протамины и гистоны. Протамины содержатся в составе головок сперматозоидов у некоторых рыб. Они отличаются ясно выраженным щелочным характером. Это их свойство объясняется тем, что молекула протамина состоит главным образом из полиаминокислот, обладающих также щелочными свойствами. Гистоны отчасти также находятся в составе головок сперматозоидов, а отчасти встречаются и в других образованиях тела. Так, гистон входит в состав кровяной краски. По своему химическому характеру гистоны стоят посредине между протаминами и альбуминами.
Протеидами называются вещества, состоящие из соединения белка с небелковой (простетической) группой. По химическому характеру простетической группы протеиды разделяются на три категории: хромопротеиды, гликопротеиды, нуклеопротеиды. К числу хромопротеидов относится гемоглобин крови. Он состоит из соединения белка (гистона) с железистым органическим соединением, гематином. Последнему приписывают формулу C32H32N4FeO4. Гематин принадлежит к числу производных пиррола. Отметим, что хлорофилл растений также содержит в себе красящее вещество, принадлежащее к производным пиррола и близкое по своему химическому строению к гематину. Гликопротеиды представляют собой соединение белковых веществ с телами, принадлежащими к классу углеводов. Поэтому, при кипячении с разведенными кислотами, они расщепляются на белок и на тело, дающее реакцию сахара. Впрочем, по-видимому, от гликопротеидов отщепляется не сахар, а какое-то его производное; в некоторых случаях от гликопротеидов отщепляется глюкозамин. Особую подгруппу гликопротеидов составляют хондропротеиды, состоящие из соединения белка с хондроитиносерной кислотой. К числу хондропротеидов относится хондромукоид хряща и амилоид, встречающийся при амилоидном перерождении органов. Нуклеопротеиды входят в состав клеточных ядер, образуя собой так называемый «хроматин» ядра. Нуклеопротеиды образованы соединением белка с нуклеиновой кислотой. Последняя представляет собой сложное тело, состоящее из фосфорной кислоты, пентозы, и одного или нескольких пуриновых или пиримидиновых оснований. К числу пуриновых оснований, входящих в состав нуклеиновых кислот, относятся аденин, гуанин, гипоксантин и ксантин. Из пиримидиновых оснований в составе нуклеиновых кислот встречаются: цитозин, урацил и тимин.
Альбуминоиды составляют группу, которая характеризуется более происхождением вещества, чем его химическим строением. Именно, к составу этого класса белковых веществ относятся малоизученные вещества, служащие в организме материалом для построения опорной и покровной тканей. Таковы: коллаген клейдающих волокон соединительной ткани, кератит роговых образований, эластин упругой соединительной ткани и пр.
Некоторые считают альбуминоиды упрощенными белковыми веществами, содержащими в составе своей молекулы не все атомные группы, характерные для белка. Однако, по-видимому, это очень пестрая смесь веществ, которые объединены в одну группу лишь вследствие недостаточного изучения их состава. Можно думать, что впоследствии эта группа прекратить свое существование и будет разнесена по другим группам белковых веществ. См. руководства по физиологической химии (Гаммарстена, Абдергальдена); там же приведен подробный список литературы.
В. Завьялов.
| Номер тома | 7 |
| Номер (-а) страницы | 330 |
