Эфиры
Эфиры, органические соединения, в которых два радикала — один из чих должен быть непременно спиртовым или фенольным, а другой может быть или такого же характера или радикалом кислотным — связаны кислородом. В первом случае эфиры называются простыми, во втором — сложными. Спирты и фенолы, образующие эфиры, могут быть различной атомности, а кислоты — минеральными, органическими различной основности. Так как при образовании эфиров выделяется вода из водных остатков, то эфиры принадлежат к ангидридным соединениям.
Простые эфиры одноатомных спиртов бывают собственно простыми эфирами, когда содержат одинаковые радикалы, например;
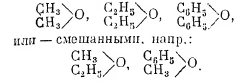
Общие способы получения простых эфиров следующие: действие подюров на алкоголяты: C2H5ONa + CH3J = NaJ + C2H5OCH3, или отнятие воды от спиртов серной кислотой или пропусканием паров спиртов через нагретые катализаторы (особенно содержащие Аl2O3). Простые эфиры, за исключением метилового, который газообразен, — нейтральные жидкости, летучие и горючие, или твёрдые тела. Простые эфиры довольно индифферентны. В отличие от спиртов, на них не действуют ни натрий, ни пятихлористый фосфор при обыкновенной температуре; ни вода, ни щелочи их не омыляют (разлагают) без давления. Йодистый водород при нагревании разлагает их на иодюр и спирт, например:
![]()
На этой реакции основывается определение метоксильных групп (ОСН3) в природных органических соединениях, весьма часто встречающихся в растительных продуктах (сложных углеводах, алкалоидах, метиловых эфирах, фенолах и др.).
Обыкновенный, или этиловый, эфиры,
![]()
неправильно называемый серным эфиром, является наиболее важным и давно известным представителем этого класса. Приготовление его действием на спирт серной кислоты было открыто ещё в 1540 г. Валерием Кордом; процесс и роль серной кислоты изучались различными учёными (особенно Митчерлихом), но были окончательно разъяснены Вильямсоном. Им же было установлено правильное отношение эфиры к спирту. Согласно Вильямсону, действие серной кислоты сводится к образованию этилосерной кислоты, при действии на которую спирта образуется эфиры:
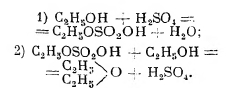
Что реакция протекает так, Вильямсон доказал образованием смешанного эфира в случае подливания к этилосерной кислоте другого спирта, например, амилового:
![]()
Этиловый эфиры — бесцветная, подвижная, очень летучая жидкость, температура кипения 35°, температура плавления — 117,6°, удельный вес 0,731 (при 4°); не смешивается с водой, но в ней отчасти растворяется; в этиловом эфире вода также растворяется. Этиловый эфир растворяет многие соединения — как органические (особенно жиры), так и некоторые неорганические (йод и некоторые соли). Применяется для извлечения и количественного определения жиров. Пары его тяжелы и горючи и с воздухом взрывают. При вдыхании паров этилового эфира сперва наступает возбуждение, а затем потеря чувствительности, почему он применяется при хирургических операциях; такой эфир должен быть особо чистым (Aether pro narcosi).
Эфиры многоатомных алкоголей. Многоатомные алкоголи способны образовать простые эфиры как с одноатомными алкоголями, так и выделением воды за счёт своих собственных спиртовых гидроксилов. Так, этиленгликоль даёт, например, с метиловым алкоголем эфиры: СН3ОСН2СН2ОН и СН3ОСН2СН2ОСН3, а также
![]()
Эфиры с одноатомными спиртами не представляют особого интереса, хотя метиловые эфиры многоатомных фенолов распространены в растениях, а эфиры углеводов играют в последнее время довольно важную роль при установлении строения углеводов. Эфиры второго типа, т. н. окиси двухатомных радикалов, представляют значительный интерес и связаны с многими важными группами органических соединений. В соответствии с принципами стереохимии, особенно прочными являются окиси из 5 и 6 членов в цикле:
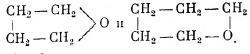
Подобные циклические группировки, — причём в каждом звене СН2 водород замещён группой ОН, что значительно уменьшает устойчивость цикла, — входят в окисные формы глюкоз.
Тетрагидро-фуран, представляющий продукт присоединения 4 Н к фурану (см. фурфуран),
![]()
важный кислородный гетероцикл, образующийся в форме производных (фурфурола и др.) из углеводов. Окиси терпенового ряда, например, цинеол (см.), нередко встречаются в эфирных маслах.
Особый класс простых эфиров представляют производные неспособных к существованию двухатомных и трёхатомных (и одного четырёхатомного) спиртов с водными остатками при одном атоме углерода, например: СН2(ОН)2, СН(ОН)3, С(ОН)4. Первое соединение представляет гидрат, отвечающий муравьиному альдегиду, второе — ортомуравьиную, третье — ортоугольную кислоту. Подобные производные этана будут: СН3СН(ОН)2 и СН3С(ОН)3; второе соединение — ортоуксусная кислота. Простыми эфирами будут для метилового и этилового спирта: СН2(ОСН3)2 — метилаль, СН3СН(OC2H5)2 — ацеталь, СН(ОС2Н5)З — ортомуравьиный эфир и С(ОС2Н5)4 — эфир Бассета, или ортоугольный.
Сложные эфиры. Сложные эфиры формально, по способам образования из спиртов и кислот и по строению, аналогичны солям, но по свойствам существенно отличны. Различают сложные эфиры минеральных и органических кислот. Образуются они прямым взаимодействием спиртов с кислотами. Реакция идёт с выделением воды и сопровождается малым тепловым эффектом. При обыкновенной температуре реакция протекает чрезвычайно медленно, с повышением температуры скорость её возрастает, но до конца она не доходит — ограничена пределом, т. к. продукты реакции снова могут давать исходные вещества. Вследствие очень малого теплового эффекта реакции, предел её не зависит от температуры, но зависит от относительных количеств спирта и кислоты (по закону действующих масс) и от характера и строения спирта (и кислоты). Устраняя выделяющуюся воду (например, серной кислотой или НСl) и беря избыток кислоты, можно достигнуть почти полного переведения спирта в эфир. Для эквимолекулярных количеств этилового спирта и уксусной кислоты реакция изобразится так:
![]()
(знак ↔ указывает на обратимость). Для получения сложных эфиров можно прибегать к действию на спирты ангидридов кислот:
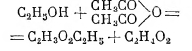
или к действию галоидных алкилов на соли (особенно серебряные) кислот:
![]()
Сложные эфиры минеральных кислот. Сложные эфиры галоидоводородных кислот представляют галоидные производные углеводородов, например:
![]()
Из эфиров других минеральных кислот применяются азотистые эфиры — CH3ONO, С2H5ONO, газообразные и жидкий изоамиловый (амилнитрит, см.), С5H11ONO — для диазотирования вместо азотистой кислоты; последний, кроме того, — в медицине. Азотистые эфиры ядовиты. Эфиры азотной кислоты отличаются взрывчатостью, и азотные эфиры многоатомных спиртов, например, нитроглицерин,
![]()
и азотные эфиры клетчатки — пироксилин — широко применяются как взрывчатые вещества (см.).
Многоосновные кислоты образуют кислые эфиры или эфирные кислоты, и средние. Так, серная кислота с метиловым спиртом даёт метилосерную кислоту, CH3OSO2OH, и метилсульфат, SО2.(ОСН3)2, а с этиловым — этилосерную кислоту, С2Н5ОSО2ОН, и этилсульфат, SО2(ОС2Н5)2. Кислые эфиры представляют сильные одноосновные кислоты. Этилосерная кислота образуется не только действием серной кислоты на спирт, но и действием её на этилен и играет роль промежуточного продукта при получении этилена из спирта (и обратно), а также при приготовлении из спирта эфира. Кроме того, ею пользуются для получения различных соединений, заключающих С2Н5 (как и йодистым этилом). Ядовитый метил сульфат, способный легко вступать в реакции двойного разложения, служит для метилирования, например:
![]()
реакция течёт при обыкновенной температуре в водном растворе, эфиры фосфорной кислоты, жирных кислот и глицерина входят в состав лецитинов, а эфиры инозита, C6H6(ОН)6, и фосфорной кислоты — в состав фитина.
Сложные эфиры органических кислот. Известно громадное число сложных эфиров, так как каждый спирт может образовать сложный эфир с каждой кислотой. В этом классе имеется множество случаев метамерии1 и настоящей изомерии. Сложные эфиры весьма распространены в живой природе. Физические свойства сложных эфиров разнообразны и зависят от природы спирта и кислоты. Сложные эфиры простых одноосновных кислот и одноатомных предельных алкоголей (если их молекулярный вес не особенно высок) представляют бесцветные, подвижные, летучие жидкости с особым приятным запахом плодов (груш, ананаса) и ягод и находят применение в качестве фруктовых эссенций (см. эссенции), а уксусно-этиловый эфиры (температура кипения 78°) применяется также для приготовления бездымного пороха. Сложные эфиры высших одноосновных кислот и одноатомных спиртов — твёрдые, жирные на ощупь тела, лишённые запаха, как, например, эталь, C16H31OOC16H33 — сложный эфир пальмитиновой кислоты и цетилового алкоголя. Эталь добывается из спермацета, содержащегося в черепной полости кашалота. Подобными свойствами обладают сложные эфиры, встречающиеся в восках. Сложные полные эфиры глицерина (глицериды) и одноосновных кислот высокого молекулярного веса (предельной C16H32О2 пальмитиновой и с 18 атомами углерода — предельной стеариновой, С18Н3402, и непредельных С18Н34О2, С18Н32О2 и С18Н30О2) образуют жиры растений и животных. Глицериды твёрды или жидки, нелетучи, нерастворимы в воде; растворимы в эфирах и некоторых других растворителях. Все сложные эфиры в чистом виде нейтральны, и самой характерной для них реакцией является разложение их водой:
![]()
Реакция называется гидролизом, или омылением. Она весьма ускоряется (как и все реакции) с повышением температуры и под влиянием катализаторов: кислот, щелочей и ферментов.
1) Грубый случай изомерии, вызываемой тем, что многовалентный атом (или не содержащий С радикал, например, NH) удерживает в связи радикалы разной величины, но в сумме содержащие одинаковое число атомов. Так, например, метамерны
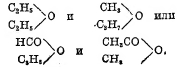
Н. Демьянов.
| Номер тома | 54 |
| Номер (-а) страницы | 814 |
