Электрохимия прикладная
Электрохимия прикладная. Электрохимические процессы главным образом используются в двух областях техники. Первая область — это получение и рафинировка металлов, а потому этот раздел технологии обычно называется электрометаллургией. Вторая область — это получение путем электролиза химических элементов неметаллического характера и разнообразных химических соединений. Эта область может быть названа электрохимической технологией. Конструкции технических гальванических элементов и область их применения здесь рассматриваться не будут (см. гальванизм и аккумуляторы).
Электрометаллургия. Наиболее старым и имеющим наибольший объем процессом является электролитическая рафинировка меди. Достаточно указать, что в США за 1929 г. было получено 1 200 000 т электролитной меди, а в качестве побочных продуктов – 1200 т серебра и 12 т золота.
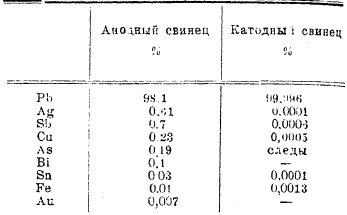
При электролитическом рафинировании (см. XXIX, приложение медные руды, 493’/94’) медь, употребляемую в качестве анодов и содержащую 98-99% Cu, переводят в раствор в виде сернокислой меди и выделяют из последнего на катоде. При этом катодная медь получается с содержанием 99,95-99,99% Cu. Из загрязняющих исходную медь примесей одни, переходя в раствор, не выделяются на катоде (никель, цинк), другие, образуя плохо растворимые соединения, выпадают в осадок (свинец, сурьма, висмут, мышьяк, серебро), и третьи, по мере растворения анода, не переходя в раствор, ссыпаются с него. Осадок, образующийся на дне электролитической ванны вследствие вышеуказанных процессов, называется анодным шламом. Для иллюстрации результатов процесса может служить следующая таблица:
Анодный процесс при рафинировке заключается в переходе металлической меди в виде Cu·· в раствор. Однако, в некоторой степени происходит и процесс образования Cu·. Но в растворе возникают процессы:

в результате которых часть меди уходит в шлам, причем расходуется серная кислота. Чтобы избежать этих нежелательных побочных реакций, необходимо применять: 1) не слишком малую плотность тока, 2) не слишком высокую температуру электролита, 3) не сильно концентрированные растворы сернокислой меди, 4) подкисление раствора.
В техническом электролизе обычно работают с растворами, содержащими 12—16% СuSO4·5Н2O и 5—10% H2SO4 при температуре 40—50° и плотности тока в пределах 150-300 А/м2. Так как As, Sb и Bi, являющиеся весьма нежелательными примесями, с анода переходят в раствор и лишь после гидролиза образовавшихся солей выпадают в осадок в виде основных солей и окисей, то имеется опасность загрязнения этими металлами катодной меди. Поэтому предпочитают на рафинировку пускать возможно более высокопроцентную медь с содержанием Cu во всяком случае не ниже 98%. Чем чище анодная медь, тем более высокую плотность тока можно применять без опасности загрязнить катодную медь. Кроме того, более чистая анодная медь дает возможность реже заменять загрязненный электролит свежим. Из анодного шлама после извлечения меди извлекаются сконцентрировавшиеся в нем серебро и золото.
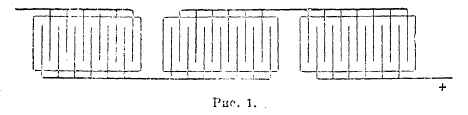
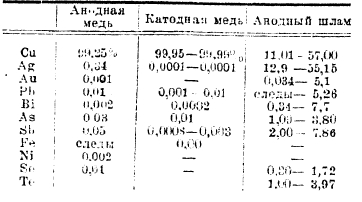
Рис. 1.
В технике в настоящее время применяют две системы электролиза: параллельного включения и последовательного. В первой все катоды ванны соединены между собой параллельно, как и аноды (рис. 1), отдельные же ванны соединяются последовательно падение в серию. Ванны, обычно деревянные, электродами изнутри выложенные рольным свинцом, располагаются каскадом, и циркулирующий электролит перетекает последовательно из верхней ванны в нижние (рис. 2). Из последней ванны он течет в сборный чан, откуда аэролифтом подается в верхний питательный чан. Электроды имеют размер в пределах 0,5—0,7 м2 и расположены на расстоянии 5 см друг от друга.
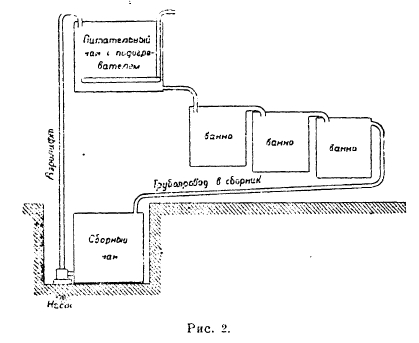
Рис. 2.
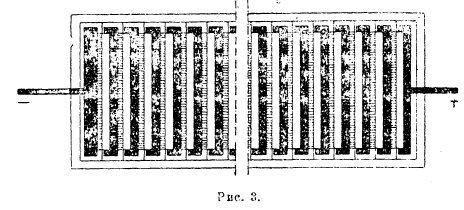
Рис. 3
Падение напряжения в ванне обычно равно 0,25 вольт.
При последовательной системе Гайдена аноды из вальцованной меди плотно вставляются в пазы стенок и дна ванны и помещаются на расстоянии 1 см друг от друга. Ток подводится лишь к двум крайним электродам (рис. 3), средние электроды являются биполярными, т. е. с одной стороны они растворяются (зачерченная часть), а на другой откладывается электролитная медь (заштрихованная часть). Режим электролиза здесь такой же, как и в параллельной системе.
Выход по току в параллельной системе около 96%, в последовательной – ввиду неизбежных утечек тока – не выше 90%, но падение напряжения в ней между электродами равно лишь 0,15 вольт.
Поэтому затрата электрической энергии в последовательной системе на тонну электролитной меди меньше, но эта система требует для обслуживания более квалифицированного персонала и затрат на вальцовку анодов, тогда как в параллельной системе аноды применяются литые и литье их механизировано.
Электрорафинировка серебра (по Мебиусу) проводится обычно над металлом с содержанием около 95% серебра. Значительно реже рафинируемый металл содержит 70-80% серебра. При рафинировке загрязняющая металл медь переходит в раствор, где и остается, а в получающемся на анодах шламе концентрируется золото и платиновые металлы. Электролиз производится обычно в керамических ваннах, где аноды и катоды соединены параллельно. Аноды помещаются в натянутые на рамки парусиновые мешки, на дне которых собирается шлам. Серебро на катодах, которые делаются из листового алюминия или серебра, выделяется в виде рыхлого кристаллического осадка и систематически соскабливается с катодов с помощью двузубчатых вилок. Осаждаясь на дно ванны, серебро оттуда периодически вычерпывается и переплавляется в слитки. Электролит содержит обычно 1—2% азотнокислого серебра и 1% азотной кислоты и во время электролиза постепенно обогащается медью. Когда содержание в нем меди достигнет 5%, электролит подвергают регенерации. Тогда оставшееся в растворе серебро вытесняется медью, а медь выделяется электролизом при нерастворимых анодах. Применяемая при электрорафинировке плотность тока обычно лежит в пределах 200—250 А/м2, падение напряжения на каждой ванне около одного вольта, и выход по току составляет 96—97%. Катодное серебро содержит обычно 99,6-99,9% серебра и (как примесь) медь.
Так как в этих ваннах аноды могут быть растворены лишь на 75-80%, то анодные остатки дорабатывают обычно в ваннах Бальбаха-Тума (рис. 4). Здесь аноды помещаются в решетчатый ящик с расположенной на дне тканью, и ток подводится к ним сверху. Серебро выделяется на графитовом днище ванны и вычерпывается после сдвигания к другой стороне ящика с анодами. Режим электролиза здесь такой же, как и в ваннах Мебиуса, и аноды могут быть доработаны до 95%. Ванны с ленточным катодом, двигающимся во время электролиза и выносящим осевшее серебро из ванны наружу, так называемые «бандаппараты», до сих пор особого распространения из-за ряда недостатков не получили.
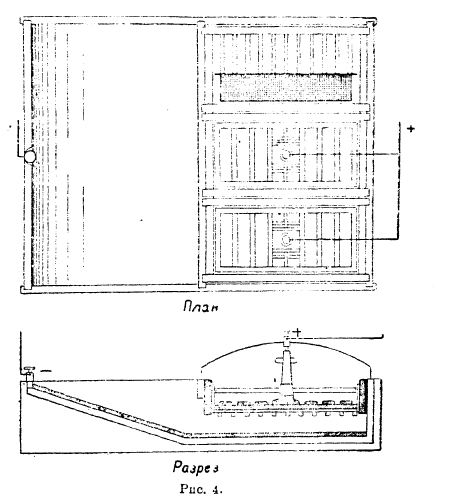
Рис. 4
Электрорафинаж золота обычно является последней стадией его очистки. Аноды из золота сырца содержат 94% золота, 5% серебра и 1% других металлов (свинец, металлы платиновой группы, медь, цинк). Электролиз по способу, разработанному Вольвиллем. ведется из раствора, содержащего 50 г/литр золота в виде HAuCl и 25 г/литр свободной соляной кислоты при температуре 60-70°С. В фарфоровые ванны помещаются аноды, завешиваемые на подводящих ток штангах по нескольку в ряд (4—6 шт.), и соответствующее количество катодов из листового чистого золота. Анодные, как и катодные штанги соединены параллельно. Плотность тока при анодах с высоким содержанием золота применяется в 3 000 А/м2 при низкопробном - в 1 000 А/м2. На катодах золото отлагается в виде плотного массивного осадка. Анодный процесс вследствие наличия поляризации протекает как с образованием ионов трехвалентного золота, ![]() , так и одновременно с образованием одновалентного
, так и одновременно с образованием одновалентного ![]() . Т. к. в растворе должно иметь место равновесие: 3 Аu° ↔ Аu°°° + Аu, а анодное растворение золота происходит с избыточным относительно равновесного состояния образованием ионов одновалентного золота, то в растворе происходит процесс выделения в шлам металлического золота: 3 Аu° → Аu°°° + Аu↓. Этот процесс при неправильном режиме электролиза может уводить в шлам до 20% золота. Анодная поляризация, как нашел Вольвилль, значительно уменьшается при наложении переменного тока. Последнее, кроме того, заставляет спадать с анодов образующиеся на них хлористое серебро и свинец, т. е. предотвращает механическую массивность анодов. Поэтому такое наложение переменного тока при электролизе золота в настоящее время обязательно проводится.
. Т. к. в растворе должно иметь место равновесие: 3 Аu° ↔ Аu°°° + Аu, а анодное растворение золота происходит с избыточным относительно равновесного состояния образованием ионов одновалентного золота, то в растворе происходит процесс выделения в шлам металлического золота: 3 Аu° → Аu°°° + Аu↓. Этот процесс при неправильном режиме электролиза может уводить в шлам до 20% золота. Анодная поляризация, как нашел Вольвилль, значительно уменьшается при наложении переменного тока. Последнее, кроме того, заставляет спадать с анодов образующиеся на них хлористое серебро и свинец, т. е. предотвращает механическую массивность анодов. Поэтому такое наложение переменного тока при электролизе золота в настоящее время обязательно проводится.
Из платиновых металлов в раствор переходит большая часть платины и палладий. По мере накопления их в растворе, электролит после предварительного осаждения золота химически перерабатывается для извлечения этих металлов.
Электролитическая рафинировка свинца и висмута. Электрорафинировкой свинца пользуются для получения особо чистого металла для специальных целей (например, производство свинцовых аккумуляторов), а так же для выделения висмута из свинца с высоким содержанием этого металла. Электролиз проводится в деревянных ваннах, покрытых слоем какого-либо кислотостойкого материала, и электроды соединяются параллельно. Наиболее распространенным электролитом, предложенным Беттсом, является раствор кремнефтористого свинца (80 г/литр Рb) и свободной кремне-фтористо-водородной кислоты (100 г/литр). Для получения более гладкого осадка катодного свинца в раствор вводится желатин (0,1 г/л.). Плотность применяемого тока обычно равна 150 А/м2, падение напряжения в ванне составляет 0,35 вольт, и выход по току обычно равен 90%. В нижеследующей таблице представлен результат рафинирования:
Кроме этого электролита, применяют иногда растворы свинцовой соли борофтороводородной или хлорной кислоты, но эти электролиты менее распространены.
При рафинировке свинца, богатого висмутом, анодный шлам может содержать до 80% этого металла и по сплавлении его может быть подвергнут электрорафинировке с получением чистого висмута на катоде. Электролиз ведется из раствора кремнефтористого висмута, содержащего свободную кремнефтористоводородную кислоту. Условия электролиза практически те же самые что и при рафинировке свинца.
Электрорафиниривка других металлов, как то: железа, никеля, олива и сурьмы, сколь-либо широкого распространения до сих пор не получила, хотя в отдельных случаях и применяется (никель).
Гидроэлектрометаллургическая переработка руд в настоящее время применяется лишь для получения меди и цинка. Задачей здесь является перевод содержащегося в руде металла в раствор путем действия соответствующего реагента и последующего выделения металла на катоде электролизом с применением нерастворимого анода. Медь, встречающаяся главным образом в виде сульфитных руд, несмотря на многочисленные исследования, проводимые в этой области, из сульфитов гидроэлектрометаллургически не перерабатывается. Переработке этим методом подвергаются медные окисленные руды. В широких размерах это проводится фирмой Chile Copper Со в Chuquicamata в Чили, где работает завод с производительностью 60 000 т электролитической меди в год. Измельченная руда с содержанием около 1,6% меди подвергается выщелачиванию раствором, содержащим 5,5% серной кислоты и 1,5% меди. При этом получается раствор с 5% меди и некоторым остатком свободной серной кислоты. В руде остается неизвлеченным около 12% от содержащейся меди. Из вредных примесей в раствор переходят Сl’ и железо.
Первый удаляется путем обработки раствора порошкообразной металлической медью; при этом выпадает трудно растворимая хлористая медь:
CuCl2 + Cu → 2CuCl↓
Железо, находящееся в растворе, вызывает сильное снижение выхода тока, т. к. при электролизе происходит восстановление железа из трехвалентного в двухвалентное на катоде и обратное окисление его на аноде:
![]()
Поэтому перед электролизом большую часть железа удаляют, например действием на горячий раствор окисью меди при продувании воздуха:
![]()
а оставшееся железо восстанавливают до закисного (например, действием сернистого газа). Очищенный раствор подвергают электролизу при плотности тока на катоде в 120 А/м2, выделяя электролитную медь, содержащую 99,96% Сu. Чтобы избежать накопления в растворе загрязнений, лишь 85% раствора из электролитных ванн возвращают на выщелачивание, а из 15%, выделив медь цементацией ее железным скрапом: CuSO4 + Fe → FeSО4 + Сu↓ раствор выбрасывают.
В качестве материала для нерастворимых анодов можно потреблять свинец, но в рудах Чили содержится NO’3 и там для анодов применяют сплав Chilex, содержащий 60% Сu, 5% Si, 8% Fe и 7% других металлов Рb?).
Электролитический цинк, производство которого началось с 1914 г., в настоящее время получил широкое распространение благодаря его высокой чистоте (см. XLV, ч. 3, 436). В СССР в 1934 г. пущен первый завод электролитного цинка в г. Орджоникидзе; строятся и другие заводы.
Гидроэлектрометаллургической переработке обычно подвергают свинцово-цинковые руды, которые предварительно обогащаются путем селективной флотации. При этом получают концентраты: один — обогащенный свинцом, другой - цинком. Последний обычно имеет состав:
Цинка 30%
Свинца 7%
Меди 4%
Железа 13%
Серебра 514 г/т
Концентрат этот подвергается обжигу в механических печах, при этом большая часть сернистого цинка переходит в окись цинка и некоторая часть в сульфат. Обжиг стараются вести при не слишком высокой температуре, т. к. иначе образуются ферриты цинка, из которых цинк разбавленной серной кислотой не извлекается.
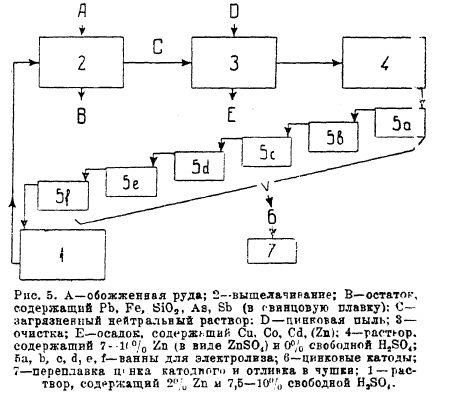
Рис. 5
Дальнейшая переработка в настоящее время совершается по двум основным методам. Первый, более старый, так называемый стандартный способ, проводится по схеме рис. 5. Первой стадией процесса является выщелачивание, которое производят в чанах Пачука (рис. 6) и совершают в две стадии. В первой уже частично выщелоченный концентрат обрабатывают раствором, поступающим из электролитических ванн (7,5-10% H2SO4 + 2% Zn), производя окончательное извлечение цинка. Твердый остаток, содержащий сернокислый свинец, идет в переработку на свинцовый завод. Свежий концентрат подвергают частичному выщелачиванию раствором, полученным от вышеописанной операции. При этом происходит окончательная нейтрализация раствора, из которого при этом вследствие гидролиза осаждается железо в виде гидрата окиси, увлекая с собой перешедшие в раствор мышьяк и сурьму. После этого раствор подвергают тщательной очистке от находящихся в нем меди и кадмия, остатков сурьмы и мышьяка и имеющегося иногда кобальта. Это производится путем вытеснения этих металлов металлическим цинком, вводимым в виде цинковой пыли. Осветленный фильтрованием раствор поступает на электролиз, протекая через ряд (6 шт.) ванн, где на катоде из раствора выделяется цинк, и электролит, обедняясь им, обогащается кислотой и по выходе из ванн поступает на новое выщелачивание.

Рис. 6
Электролиз обычно ведется при плотности тока, равной 400 А/м2, при этом напряжение между анодом и катодом равно 3,4—3,8 вольт. Аноды делаются из свинца и катоды из алюминия с которого осевший цинк легко снимается и идет на переплавку и отливку в чушки.
Одним из важнейших условий успешного электролиза является чистота раствора, особенно в отношении следов меди, мышьяка, сурьмы и кобальта. Выделение цинка из кислого раствора возможно потому, что перенапряжение водорода на этом металле весьма велико. Если же вместе с цинком выделяются вышеуказанные металлы, перенапряжение водорода на которых значительно ниже, то на тех местах катода, где выделились эти металлы, начинается бурное выделение водорода, и выход цинка по току сильно падает, иногда до нуля.
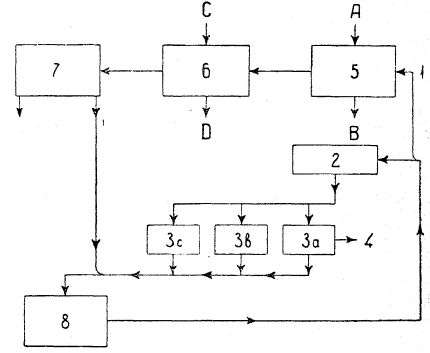
Рис. 7. 1—раствор, содержащий 30% Н2SO4 и 3% Zn; А — обожженый концентрат; 5 — выщелачивание; В — остаток, содержащий Рb, Fe, SiO2, As, Sb — в свинцовую плавку; С — цинковая пыль: 6 - очистка раствора; D — осадок, содержащий Сu, Co, Cd, (Zn); 7 — раствор, содержащий 22% Zn и 0% свободной В2SO4; 8 — раствор для питания электролитных ванн; 2 — охладитель; За, b, с — ванны для электролиза; 4 — электролитный катодный цинк.
На рис. 7 дана схема процесса Тентона. Здесь основным отличием является электролиз растворов с значительно более высоким содержанием серной кислоты и при значительно более высокой плотности тока, доходящей до 1100 А/м2. При этой плотности тока электролит сильно разогревается, вследствие чего его приходится охлаждать. Так как для выщелачивания здесь применяется более кислый раствор, то оно идет с извлечением цинка и из ферритов, вследствие чего обжиг концентрата можно проводить при более высокой температуре. Процесс Трентона, как более новый, лишь начинает входить в технологическую практику. Несмотря на его большую сложность, он имеет ряд важных преимуществ, первое из которых – более высокая рабочая плотность тока.
Гальваностегия ставит своей задачей электролитическое осаждение металла на поверхности металлического предмета (чаще всего железного) в виде плотно спаянного с основным металлом мелкокристаллического осадка. Целью таки го покрытия является или придание предмету красивого внешнего вида (декоративное покрытие), или предохранение основного металла от коррозии (ржавления). Насколько широкое распространение имеет этот процесс указывает то, что по Пфанхаузеру еще в 1914 г. 15 000 т различных металлов выделялось электролитически в виде гальваностегических осадков. В настоящее время, с развитием автостроения в частности и машиностроения вообще, роль гальваностегии значительно возросла. Одной из причин этого является то, что нанесение таких металлов, как цинк, олово и свинец, хотя и возможно «горячим способом» (погружение подлежащих покрытию предметов в расплавленный металл), однако оно менее экономично, чем гальваностегический способ. Нанесение же таких металлов, как хром, никель и кобальт в виде гладкого блестящего слоя возможно лишь гальваностегически.
Так как одним из основных требований является прочное сцепление металлического осадка с поверхностью покрываемого предмета, то предварительная подготовка поверхности предмета становится одной из важнейших операций. Прежде всего, предмет подвергают механической обработке на пескоструйных аппаратах или кругах для очистки поверхности его от окислов и выравнивания ее (полировка). После этого для удаления жировых загрязнений с предмета его подвергают действию раствора щелочи или промывают в органических растворителях. Наконец, последними операциями перед загрузкой в электролитную ванну будут травление в кислотах для удаления слоя окисла и промывка.
Ванны для электролитического покрытия обычно делают деревянные изнутри освинцованные (железные – для хромирования), или керамические. Предметы, подлежащие покрытию с помощью контактных приспособлений, подвешиваются в электролите на катодных штангах, а аноды делаются из металла, которым предмет покрывается. Что касается электролитов и режима электролиза (плотность тока, температура), то они подбираются такими, чтобы осадок получился возможно более мелкокристаллическим и состоящим из плотно спаянных между собой отдельных кристаллов. При этом часто возможно получить блестящий осадок, имеющий как бы полированную поверхность (никелирование, хромирование). Кроме того, важно, чтобы металл осаждался по всей поверхности предмет равномерным слоем.
Наиболее распространенными из гальваностегических покрытий являются цинковые, никелевые, хромовые, серебряные и золотые. Подсобную роль играет меднение, и начинают прочно внедряться методы электролитического лужения, освинцовывания и кадмирования. Возможно также наносить электролитическим путем сплавы, как-то: латунь, бронзу и т. д., из соответствующих растворов, содержащих соли металлов, входящих в сплав.
Гальванопластика (см. XII, 464/65).
Возможно и широко применяется количественное выделение одного металла из смеси солей металлов электролизом. Это является особым методом количественного анализа, называемого электроанализом.
Электролитический способ является единственным технически применяемым для получения щелочных (Na, Li, K) и щелочноземельных металлов (Са, Sr, Ва), а также алюминия и магния.
Натрий, который применяется главным образом как восстановитель и для получения перекиси натрия, начали получать путем электролиза расплавленного едкого натрия. Процесс электролиза заключается в выделении металлического натрия на катоде:
![]() и в разряде ионов ОН' на аноде, приводящем к образованию кислорода и воды:
и в разряде ионов ОН' на аноде, приводящем к образованию кислорода и воды:
![]()
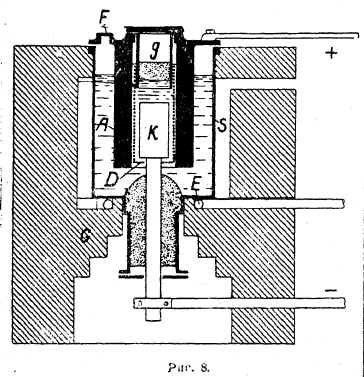
Рис. 8
Технический электролизер Кастнера, имеющий до сих пор широкое распространение, изображен на рис. 8. В кирпичной кладке С вставлена железная ванна S, обогреваемая газовой горелкой E, служащей как для расплавления едкого натра, так и для поддержания его в этом состоянии при электролизе. На железном аноде А происходит выделение кислорода, удаляющегося через отверстие F, служащее и для загрузки едкого натра. Катод К, на котором выделяется в расплавленном состоянии натрий, отделен от анода никелевой сеткой D, которая предотвращает попадание натра в анодное пространство. Натрий, отделяясь от катода, всплывает над электролитом и собирается под колпаком g, откуда время от времени вычерпывается. Электролиз ведется при температуре около 340° с напряжением 4,5—5 вольт при плотности тока 1,5 А/см2 на аноде и 2,0 А/см2 на катоде. Выход по току не выше 40%. Это является следствием того, что образующаяся на аноде вода диффундирует в катодное пространство, где и реагирует с натрием:
2Na + 2Н2О → 2NaOH + Н2.
Поэтому был предложен целый ряд конструкций ванн, где достигалась лучшая изоляция анодного пространства от катодного и усиленное испарение образующейся на аноде воды. Однако, все эти изменения дают лишь частичное улучшение и в то же время вносят значительные сложности в конструкцию. Значительно более радикальной мерой было принятое и все более распространяющееся в настоящее время получение металлического натрия из поваренной соли. Затруднением к введению этого процесса являлась высокая температура плавления хлористого натрия.
Для понижения рабочей температуры электролита употребляют в настоящее время смесь хлористого натрия и фтористого калия и натрия (70% NaCI + 10% KF + 20% NaF), которая плавится при 610°—650°. Но при этой температуре натрий во избежание его воспламенения должен быть хорошо изолирован от соприкосновения с воздухом и от анодного пространства, куда он легко проникает ввиду его легкой текучести при такой температуре. Наиболее совершенным электролизером для этого процесса является в настоящее время ванна Доуна (рис. 9). Она состоит из железного кожуха квадратного или круглого сечения, выложенного внутри огнеупорным кирпичом S. Цилиндрический угольный анод А вводится через дно электролизера и окружается кольцевым катодом К из железа или меди. Над анодом помещен железный кожух G, с которого свешивается никелевая сетка М, диафрагмирующая катодное пространство. Выделяющийся на аноде хлор собирается в пространстве F и удаляется по трубе D. Натрий, всплывая над электролитом, попадает через трубу Н в сборник J под слой минерального масла, откуда время от времени выпускается через кран. Загрузка хлористого натрия ведется через отверстие N. Этот процесс, использующий более дешевое сырье и дающий в качестве побочного продукта хлор, рентабельнее электролиза едкого натрия.
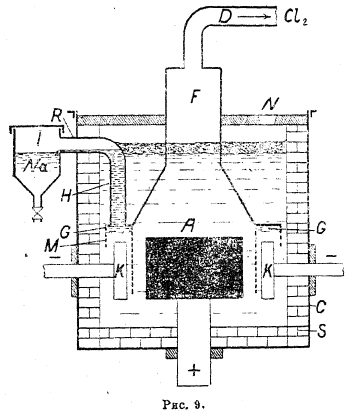
Рис. 9
За последнее время начинает расширяться получение лития электролизом расплавленного хлористого лития. Причиной явилось следующее открытие: прибавка лития в некоторые легкие сплавы (склерон — сплав алюминия с 12% цинка, 3% меди, 0,6% магния, 0,5% кремния, 0,4% железа и около 0,1% лития) сильно улучшает их механические свойства.
Из щелочноземельных металлов в значительном количестве получают кальций электролизом расплавленного хлористого кальция. Особенностью процесса здесь является то, что кальций выделяют на охлаждаемом изнутри железном катоде, постепенно поднимаемом кверху (электрод касания). При этом выделяющийся кальций, охлаждаясь, застывает на уже выделившемся ранее и получается в виде длинных штанг, покрытых сверху кристаллическим хлористым кальцием, который потом удаляется. Вести процесс таким методом нужно потому, что металлический кальций обладает способностью при повышенной температуре реагировать с расплавленным CaCl2, образуя субхлорид: СаCl2 + Са → Са2Сl2, в результате чего выделившийся кальций обратно переходит в электролит. Кроме того, в настоящее время в значительных количествах получают свинцовые сплавы кальция, стронция и бария путем выделения этих металлов из расплавленных солей, причем в качестве катода применяют расплавленный свинец. Эти сплавы употребляются для завивки подшипников (антифрикционные сплавы).
Сравнительно недавно возникло производство металлического бериллия. Оно ведется электролизом расплавленной смеси фторокиси бериллия (ВеО·5BeF2) и фтористого бария. Особенностью этого процесса является весьма высокая температура (1400°). Весьма ценным свойством бериллия является то, что медные и никелевые сплавы, содержащие бериллий (2—2,5%), очень упруги и плотны и неспособны показывать явления усталости, а отливки этих сплавов не дают пузырчатости. Это и послужило причиной развития технического получения бериллия.
Получение магния особенно сильно начало возрастать во время мировой войны. До этого магний производился лишь в Германии в весьма ограниченных размерах. Сейчас производство его ведется почти во всех странах и в 1930 г. равнялось 3 000 т. Такое широкое и быстрое развитие производства магния вызвано внедрением его в авиастроение, где сплавы, содержащие магний, весьма легкие (электрон — удельный вес 1,8-1,83), получили широкое применение. Значительно также применение магния как раскислителя при литье сплавов и изготовлении осветительных смесей. Ранее магний получался путем электролиза обезвоженного и расплавленного карналлита (КСl·MgGl2·6Н2O), который после снижения в нем содержания магния до некоторого предела шел на извлечение КСl. В настоящее время электролиз ведется беспрерывным способом. В качестве электролита употребляют также обезвоженный и расплавленный карналлит, но расходуемый хлористый магний в ванне все время пополняется. Обезвоживание карналлита, а также хлористого магния представляет некоторые затруднения, т. к. при нагревании в значительной степени происходит реакция: MgCl2 + Н2O = MgO + 2НСl. Поэтому обезвоживание ведут в атмосфере хлороводорода, а затем частично все же образующуюся окись магния обрабатывают при высокой температуре фосгеном или смесью окиси углерода и хлора. При этом окись обратно превращается в MgCl2: MgO + CO + Cl2 → MgCl2 + СO2. Электролизер американского типа представлен на рис. 10, где катодом является чугунный котел, снаружи обогреваемый. Анод из графита окружен кожухом, по которому отводится хлор. Выделяющийся магний, ввиду меньшего удельного веса сравнительно с расплавленным электролитом, всплывает и время от времени счерпывается. Окисления его при соприкосновении с воздухом не происходит, т. к. по поверхности он покрыт пленкой расплавленного электролита. Электролиз производят при температуре около 700° и при напряжении 5-8 вольт. При этом катодная плотность тока равна 100 А/см2, а анодная 500—1 000 А/см2, и выход по току приблизительно равен 70%. Загрязнение металлического магния электролитом сильно отзывается на его устойчивости, т. к. ввиду гигроскопичности последнего магний сильно коррозирует. Поэтому магний после переплавки в расплавленном хлористом калии перегоняют в вакууме. Во время войны в США было пущено производство магния электролизом смеси фтористых солей магния и бария, содержащих растворенную окись магния. Так как здесь процесс приходится вести при более высокой температуре и техническое осуществление его значительно сложнее, то пока получение магния этим методом оставлено.
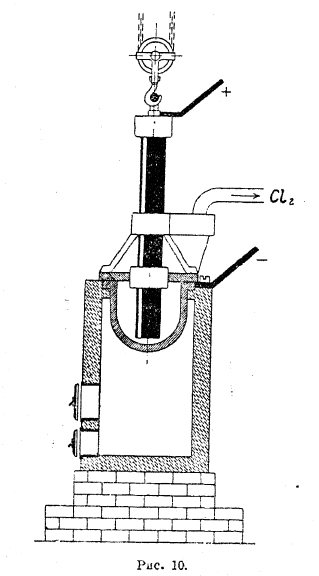
Рис. 10
Алюминий впервые электролизом был выделен Бунзеном в 1854 г., но техническое получение его началось лишь после того, как Холл, Эру и Килиани в 1887 г. нашли подходящий электролит и разработали условия электролиза. Вначале алюминий применялся главным образом для предметов домашнего обихода (посуда), а стремительное развитие алюминиевой промышленности началось лишь со времени развития авиастроения, т. е. приблизительно с 1905 г., и добыча алюминия неуклонно продолжает возрастать. В 1929 г. было получено 276 800 т этого металла (maximum получения), и производство его сосредоточено главным образом в США, Канаде, Франции, Германии и Норвегии. В 1932 г. добыча алюминия снизилась до 153,8 т. Хотя соединения алюминия весьма распространены на земной поверхности, однако до сих пор практически используемой алюминиевой рудой является лишь боксит — водная окись алюминия (Al2О3·2Н2О), мощные месторождения которой имеются во Франции, Далмации, Алабаме, Арканзасе, Гвиане. Электролитическое выделение алюминия ведется из расплава, представляющего собой 10—20% раствор криолита (3NaF·АlF3) в окиси алюминия (глинозем Аl2O3). При этом алюминий выделяется на катоде, а на угольных анодах выделяется кислород, который, реагируя с углем, дает смесь окиси и двуокиси углерода. Таким образом при электролизе разлагается лишь глинозем, и пополнять ванну приходится им, вводя криолит лишь постольку, поскольку он теряется, испаряясь при той высокой температуре (950°), при которой ведется электролиз. На получение 1 кг металлического алюминия обычно расходуется 2 кг глинозема, 0,6—0,8 кг анодного угля и 0,1 кг криолита. Для получения глинозема природный боксит необходимо бывает подвергнуть очистке от загрязняющих его соединений железа, кремния и титана. Иначе при электролизе эти металлы, выделяясь вместе с алюминием, дадут металл низкого качества. Наиболее распространенным способом получения чистого глинозема в настоящее время является способ Байера. По нему боксит после дробления и кальцинации во вращающихся печах при 350—400° подвергается тщательному размолу. После этого боксит загружается в автоклавы и подвергается при беспрерывном перемешивании при температуре 160—170° и давлении 5—7 атм. действию раствора едкого натрия крепостью в 45° Бé. При этом алюминий переходит в раствор в виде алюмината, а железо остается в виде гидрата, титан - в виде метатитанита и кремний — в виде натрово-алюминиевого силиката, — все в нерастворимом виде. Затем раствор разбавляется и быстро фильтруется через фильтр-пресс, поступая с него в железные баки, снабженные мешалками. К раствору добавляется чистый гидрат окиси алюминия, и вся масса перемешивается в продолжение 36-48 часов. При этом алюминат разлагается, и 60% всего глинозема, из находившегося в растворе, выпадает в осадок в виде гидрата, который отфильтровывается и после промывки и подсушивания подвергается обезвоживанию при 1200°, а фильтрат возвращается на новое выщелачивание. При этом процессе глинозем получается в виде рыхлой массы, содержащей 99,4—99,6% Аl2O3. Криолит, помимо добычи из природного месторождения, находящегося в Гренландии, в настоящее время в значительном количестве готовится путем взаимодействия соды, гидрата окиси алюминия и фтороводородной кислоты: 3Na2СO3 + 2Al(OН)3 + 12НF = 2Na2AlF3 + 3СO2 + 9Н2O.
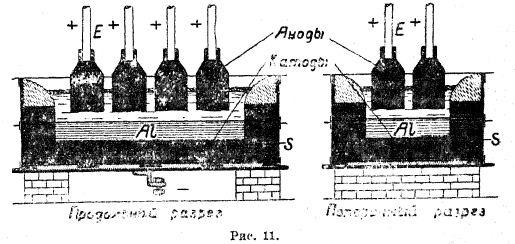
Рис. 11
Угольные аноды готовят из нефтяного кокса. Кокс предварительно кальцинируют при 900—1000° и после размола к нему прибавляют измолотый анодный огарок, пек, смолу и сажу. Всю массу тщательно перемешивают и после прессовки в блоки на гидравлических прессах подвергают обжигу при 1200-1500°. От них требуется, кроме хорошей электропроводности и высоких механических свойств, возможно меньшая зольность.
Электролизер представляет собой железный кожух с размерами в среднем 2,4 м ширины, 1—1,5 м длины и 0,7 м высоты, внутри футерованный угольными блоками (рис. 11). Для пуска ванны между анодами и подом закладывают угольную мелочь и, засыпав места соприкосновения смесью глинозема и криолита, пускают ток. Угольная мелочь, раскаляясь, постепенно расплавляет глинозем - криолитовую смесь и, когда последней наплавится достаточное количество, аноды приподнимают и пускают ванну в работу. При этом, как уже указывалось выше, на поду, являющемся катодом, выделяется жидкий алюминий, а аноды сгорают с образованием СО и СО2. В ванне на поверхности расплава, как и по стенкам ее, находится корка застывшего электролита. На нее насыпают глинозем с некоторым количеством криолита (0,05%), который по мере расходования электролита, пробив корку железным ломом, вводят в расплав. Выделяющийся на поду электролизера алюминий время от времени вычерпывают и отливают в чушки. Электролизеры работают обычно при падении напряжения в 6—7 вольт с анодной плотностью тока в 1—2 А/см2, при температуре 950°, поддерживаемой за счет Джоулева тепла, выделяющегося при прохождении тока через электролит. Металл получается с содержанием 99% Аl, при очень чистых материалах — с 99,4—99,6% Аl. Путем рафинировки можно получать металл, содержащий до 99,9% Аl, что делает его значительно более коррозионно устойчивым. Рафинировку ведут по методу Хупса. В ванне (рис. 12) нижняя часть представляет железный кожух, футерованный угольными блоками и снабженный леткой А, а верхняя — полую железную раму, футерованную огнеупорным материалом и охлаждаемую водой (К), так что на стенках рамы образуется из электролита настыль О, распространяющаяся несколько вниз и по поверхности ванны. На дно ванны вводится жидкий сплав Е, содержащий 50% меди, 10% кремния и 40% алюминия, подлежащего рафинированию. Над сплавом находится жидкий электролит, состоящий из 20% BaF2, 30% АlF3, 30% NaF и 10% Al2O3. Он имеет удельный вес меньший, чем медный сплав, расположенный внизу, и больший, чем чистый жидкий, алюминий, налитый сверху, в который погружены угольные электроды, подводящие ток. При работе ванны алюминий из медного сплава, как наиболее отрицательный металл, переходит в виде ионов в электролит и, разряжаясь на верхнем алюминиевом катоде, выделяется обратно. Содержавшиеся в нем железо и кремний при нормальной работе электролизера в электролит не переходят. По мере накопления алюминия наверху его счерпывают. Медный сплав после обеднения его алюминием до 20% выпускают через летку, заменяя свежим, а в спущенный добавляют алюминий, подлежащий рафинированию. Ванна работает при температуре 900—1100° и напряжении 6 вольт.
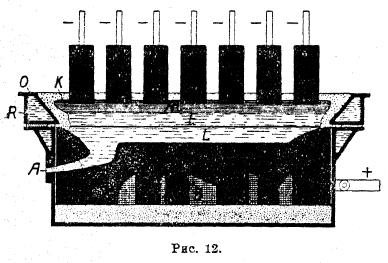
Рис. 12.
В технике применяются главным образом алюминиевые сплавы, как, например, дюралюминий (3,5 —5,5% Сu, 0,25—1,0% Мn, 0,5% Mg, ост. Аl), луталь, альдрей и др., обладающие более высокими механическими свойствами, чем алюминий.
Электролизом же расплавленных хлористых солей получают церий, сплавы которого с железом обладают способностью при дроблении давать от быстрого окисления искры. Поэтому из этих сплавов готовят кремни для карманных зажигалок.
Электротехнология. Наиболее широко распространен в настоящее время электролиз хлористого натрия. В зависимости от условий процесса здесь можно получить целый ряд веществ, употребляемых в различных производствах. На первом месте по объему производства стоит процесс электролиза хлористого натрия е получением едкого натра и хлора. Первичные продукты, получающиеся при электролизе хлористого натрия, это — газообразный хлор, образующийся на аноде:
![]() , и раствор едкого натра, образующийся на катоде:
, и раствор едкого натра, образующийся на катоде:
Если не допускать смешения анодных и катодных продуктов, то из раствора электролита, находящегося в катодном пространстве, можно выделить едкий натр. Это достигается различными способами, из которых наиболее распространенным является так называемый «диафрагменный». В применяемых при этом процессе ваннах анодное и катодное пространство разделено асбестовой диафрагмой. Раствор поступает в анодное пространство, и из него здесь выделяется хлор, отводимый из ванны по трубам. Получаемый хлор или идет на приготовление хлорной извести взаимодействием его с гидратом окиси кальция: Са(ОН)2 + Cl2 → СаСІ ОCl + Н2O, или сжижается. Раствор через диафрагму поступает далее в катодное пространство, где, согласно выше написанной реакции в нем накапливается щелочь при одновременном выделении водорода. Раствор после этого вытекает из ванны и идет на выпаривание. По мере удаления из раствора воды, из него постепенно выделяется неизрасходованный хлористый натр. При удалении последних следов влаги получается расплавленный едкий натр, содержащий небольшое количество хлористого натрия. Расплав сливается с осадка хлористого натра в железные барабаны, где и застывает. Ванны для электролитического получения едкого натра и хлора диафрагменным методом различаются по вертикальному или горизонтальному положению диафрагмы.
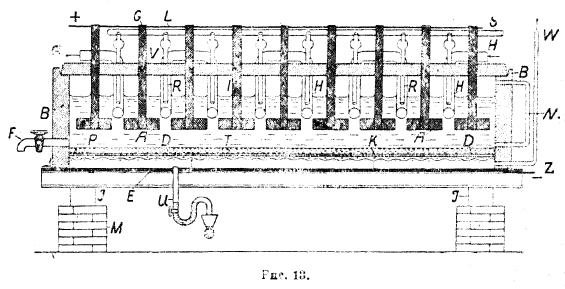
Рис. 13
На рис. 13 показана ванна с горизонтальной диафрагмой (ванна Сименс-Виллитера), где А — графитовые аноды. D — диафрагма, лежащая на катоде К, представляющем из себя железную сетку. Рассол поступает по трубе S и удаляется через трубу U. Водород из катодного пространства выделяется по трубе W. Труба для удаления из анодного пространства хлора на чертеже не видна. Электролизер этот работает при температуре рассола в 85—90° с выходом по току 94%. Выходящий из ванны рассол содержит 12—16% едкого натра. При плотности тока на аноде в 0,045 А/см2 напряжение ванны равно 3 4—3,5 вольт. Ванны эти делаются из бетона на рабочую силу тока в 2 000—4 000 А. Получающийся по этому способу едкий натр содержит некоторое количество (1%) хлористого натра. Чистый, не содержащий хлористого натра, едкий натр получают по способу «с ртутным катодом». Ванна Сольве, работающая этим методом, дана на рис. 14.
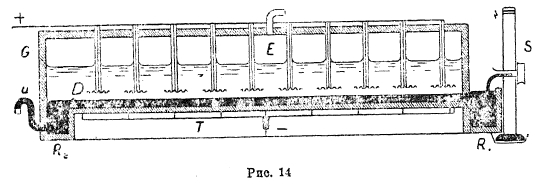
Рис. 14
Здесь по дну ванны протекает слой ртути, служащий катодом. При электролизе накат оде совершается процесс:
![]() , и выделившийся натрий образует со ртутью амальгаму, удаляющуюся через сифон U. В отдельной ванне эта амальгама взаимодействует с водой:
, и выделившийся натрий образует со ртутью амальгаму, удаляющуюся через сифон U. В отдельной ванне эта амальгама взаимодействует с водой:
2Na + 2H2О → 2Na(ОН) + Н2. Раствор получившегося едкого натра идет на выпаривание, а освобожденная от натрия ртуть, возвращается в ванну для электролиза. Анодом в ванне Сольве является платиновая сетка, и выделяющийся на ней хлор удаляется через трубу Е. Рассол поступает через трубу, неуказанную на чертеже, к катоду и, обеднившись хлористым натром, вытекает из ванны. По так называемому «способу колокола» сейчас работает весьма мало предприятий; наиболее распространен диафрагменный метод, т. к. примесь к щелочи некоторого количества хлористого натрия не вредит большинству процессов, в которых он применяется, а способ этот дает наиболее дешевую щелочь. Электролизом в настоящее время получают 50% фабрикуемого едкого натра.
В таких же ваннах ведут и электролиз хлористого калия с получением едкого калия. Если электролиз хлористого натра вести при низкой температуре, допуская тесное смешение анодного и катодного растворов, то в результате растворения хлора в воде частично происходит реакция, приводящая к образованию хлорноватистой и соляной кислот: Сl2 + Н2О → НСl + НClO, которые при взаимодействии со щелочью, образующейся на катоде, дают хлористый натр и гипохлорит натрия: НСl + НClO + 2NaOH → NaCl + NaClO + 2H2O. При таких условиях электролиза в растворе начнет накапливаться гипохлорит натрия, который применяется как отбеливающее средство в ряде производств (например, хлопчатобумажном). Тип ванны, дающей гипохлорит, представлен на рис. 15, где K – угольные катоды и А – платиновые аноды. Раствор течет из ячейки в ячейку по направлению, указанному стрелкой, постепенно обогащаясь гипохлоритом.
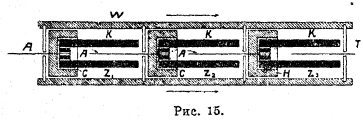
Рис. 15
Если электролиз в тех же условиях, как и для получения гипохлорита, вести при повышенной температуре (60—70°), то по мере накопления гипохлорита происходит химический процесс образования хлората:
![]()
Одновременно с этим происходит и процесс разряда ионов СlO' на аноде, и продукт реакции, вступая во взаимодействие с водой по уравнению:
![]() , дает хлорноватую и соляную кислоты, и первая с едким натром, образующимся на катоде, также дает хлорат. Производство хлоратов калия и натрия по этому способу ведется в настоящее время в широких масштабах. Ванны обычно бывают снабжены магнетитовыми анодами и железными катодами. Во избежание восстановления хлората выделяющимся на катоде водородом в раствор обычно добавляются соли хромовой кислоты, создающие на катоде пленку окислов хрома, непроницаемую для ионов СlO'3. Электролизом растворов NaCl и KCl при высоких плотностях тока возможно получение солей хлорной кислоты (НСlO4), что и практикуется в довольно значительных масштабах.
, дает хлорноватую и соляную кислоты, и первая с едким натром, образующимся на катоде, также дает хлорат. Производство хлоратов калия и натрия по этому способу ведется в настоящее время в широких масштабах. Ванны обычно бывают снабжены магнетитовыми анодами и железными катодами. Во избежание восстановления хлората выделяющимся на катоде водородом в раствор обычно добавляются соли хромовой кислоты, создающие на катоде пленку окислов хрома, непроницаемую для ионов СlO'3. Электролизом растворов NaCl и KCl при высоких плотностях тока возможно получение солей хлорной кислоты (НСlO4), что и практикуется в довольно значительных масштабах.
В связи с требованием на чистый водород, особенно широко предъявляемым со стороны технического синтеза аммиака по способу Габера, в настоящее время этот газ в значительных количествах получают электролизом растворов едкой щелочи, при котором происходят процессы:
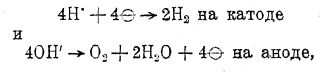 , т. е., электролиз воды.
, т. е., электролиз воды.
Электролитическое получение водорода практикуется в настоящее время в широких размерах, причем за последнее время электролиз ведут под давлением до 200 атм., т. е. получаемые газы выделяются под значительной компрессией. Последнее дает некоторые преимущества в смысле затрат электрической энергии.
Помимо получения ряда солей надкислот (особенно пербората) электролизом, употребляемых как отбеливающие средства, в широких масштабах практикуется получение электролизом надсерной кислоты из концентрированного раствора серной кислоты:
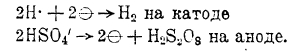
Так как надсерная кислота химически реагирует с водой по уравнению:
![]() , то этот метод дает возможность получать перекись водорода, освобождаемую затем от серной кислоты перегонкой в вакууме. При последнем процессе Н2О2 легко испаряясь, затем конденсируется в 30%-ую.
, то этот метод дает возможность получать перекись водорода, освобождаемую затем от серной кислоты перегонкой в вакууме. При последнем процессе Н2О2 легко испаряясь, затем конденсируется в 30%-ую.
Существует еще целый ряд производств, имеющих целью электролитическое получение целого ряда неорганических и особенно органических соединений путем электровосстановления или электроокисления соответствующих исходных продуктов. В одних случаях это выгоднее, чем восстановление или окисление действием соответствующих химических реагентов, в других же этот путь оказывается единственным практически возможным.
Литература. Изгарышев, Н. А., «Электрохимия и ее техническое приложение» (1931); I. Billiter, «Technische Elektrochemie» (1924); R. Müller, «Elektrometallurgie» (1932).
И. Титов.
| Номер тома | 53 |
| Номер (-а) страницы | 385 |
