Электронная теория
Электронная теория. Современная наука считает отрицательное и положительное электричество за два особого рода агента, или вещества, имеющие зернистое, или, как иногда говорят, «атомное» строение. Это значит, что они состоят из отдельных (дискретных) мельчайших частиц, могущих двигаться независимо друг от друга, если не считать тех сил, с которыми они действуют друг на друга. Элементарное количество отрицательного электричества получило название электрон, положительного — протон. Голландский ученый Г. А. Лоренц (см.) должен считаться основателем электронной теории электричества (1895), в которой он впервые ясно и определенно ввел понятие об элементарных электрических зарядах, мельчайших частицах, или атомах электричества. Впрочем, первые работы Г. А. Лоренца в этом направлении относятся еще к 1880 г.; кроме того, Гельмгольтц, Аррениус (1887, 1888), Эльстер и Гейтель (1888) и в особенности Дж. Дж. Томсон (1894) высказывали идеи, более или менее отчетливо выражавшие представление об атомном строении электричества. Стоней (1896) предложил название «электрон». Термин «протон» появился сравнительно недавно; впрочем, в английских книгах нередко пользуются термином электрон как для отрицательного, так и для положительного элементарных количеств электричества. Заслуга Г. А. Лоренца заключается в том, что он первый дал детально разработанную математическую теорию электричества, имеющего атомное строение. Эту теорию развивали затем многие ученые, прежде всего Лармор (Larmor, 1896) и Вихерт (1896). Под термином электронной теории обычно подразумевают именно эту математическую теорию. В первоначальном виде она представляла видоизменение, незначительное по внешней форме, но весьма существенное по внутреннему смыслу, — теории Максвелла (1865). Мы ее рассматривать не будем (подробное ее изложение можно найти в «Курсе физики» О. Д. Хвольсона, т. V, глава 4). Мы здесь ограничимся рассмотрением того, что известно о свойствах электрона и протона, и затем перейдем к основному вопросу о строении атома, т. е. к электронной теории.
Характеристикой электрона и протона является, прежде всего, величина их электрического заряда, т. е. то количество электричества, которое в них сосредоточено. Заряды электрона и протона совершенно одинаковы, но, конечно, различного знака. Это значит, что электрон и протон, весьма близкие друг к другу, не вызывают во внешних точках пространства никаких электрических сил, если эти точки не находятся очень близко к электрону или протону. Существует несколько способов определения заряда е электрона. Один из них основан на явлениях электролиза (см. электрохимия). Изучение этих явлений показало, что один грамм эквивалент иона содержит 9 654 электромагнитных единиц = 9654·3·1010 электростатических единиц количества электричества. Если последнее число разделить на число Авогадро—Милликена N = 6,062·10-3, т. е. на число атомов в одном грамм-атоме вещества, то получится заряд е электрона в электростатических единицах (см. электричество, LII, 21 сл.). Этот способ точных результатов дать не может. Другой способ основан на изучении браунова движения (см.) весьма малых твердых или жидких частиц, находящихся в жидкой или газообразной среде; но и этот способ не может дать удовлетворительных результатов. Удивительные по своей точности измерения заряда е произвел Р. А. Милликен (R. А. Millican), получивший за них нобелевскую премию. Они были начаты в 1908 г.; окончательные результаты были опубликованы в 1917 г. Прибор, которым пользовался Милликен, имел весьма сложное устройство. Основная мысль его метода заключается в следующем. Две круглые металлические пластинки (диаметром 22 см) расположены горизонтально на расстоянии 14,9174 мм друг от друга. Они составляют конденсатор, так что между ними находится электрическое поле, действующее на электроны по направлению снизу вверх. Воздух между пластинками ионизируется при помощи рентгеновых лучей, так что в нем находятся свободные электроны. При помощи пульверизатора вводятся в промежуток между пластинками весьма малые частицы какого-либо твердого или жидкого вещества; на эти частицы оседают электроны из окружающего воздуха, вследствие чего на них действует электрическое поле конденсатора. Всего действуют на частицу две силы: вес по направлению вниз и электрическое поле по направлению вверх. Заряд конденсатора можно так урегулировать, что частица остается неподвижной. Особенно важны те случаи, когда такая частица внезапно начинает двигаться в ту или другую сторону. Это показывает, что к ней присоединился еще один электрон или что от нее отделился электрон. Для наблюдения частица ярко освещается вольтовой дугой, а само наблюдение производится сбоку при помощи микроскопа. Подробная теория движения такой частицы дает возможность вычислить заряд электрона. Постоянно усовершенствуя свой метод, Милликен получил следующий окончательный результат: е = 4,774·10-10 электростатических единиц = 1 592·10-20 электромагнитных единиц. Отсюда следует, что одна эл.-ст. единица количества электричества содержит 2 095 миллионов электронов. При силе тока в один ампер протекает в 1 сек. 0,1 эл.-магн. единиц количества электричества; в ней содержатся 6,288 триллионов электронов, считая триллион равным 1018 (млн. в третьей степени). Как сказано, заряд протона равен заряду электрона, но обратного знака. Вопрос о том, все ли электроны имеют одинаковый заряд, занимал в течение некоторого времени ученых. Дело в том, что выдающийся физик-экспериментатор Ф. Эренгафт (F.Ehrenhaft) в Вене напечатал в 1909 г. статью с описанием опытов, которые, по его мнению, доказывали, что существуют такие частицы отрицательного электричества, заряд которых во много раз меньше того, который дает Милликен; Эренгафт их назвал субэлектронами. Спор об их существовании продолжался почти 20 лет. Эренгафт и его сотрудники продолжали с поразительной настойчивостью доказывать существование субэлектронов, производя все новые и новые опыты. Только в 1929 г. этот спор прекратился, и в настоящее время никто не сомневается, что все электроны обладают одинаковым зарядом. Предполагается, что электрон имеет шаровидную форму. Радиус а электрона определить сколько-нибудь точно невозможно. Однако, окольными путями все-таки удалось определить хотя бы порядок размера электрона. Оказалось, что а=2·10-13 см = 2·10-12 мм. Цепочка, содержащая 500 000 миллионов электронов, имеет длину, приблизительно равную одному миллиметру.
Переходим к вопросу о массе электрона, причем следует отличать массу m0 покоящегося и массу m движущегося электрона. Изучая движение электрона в электрическом и магнитном полях, можно определить величину e/m0, которая называется удельным зарядом электрона. До 1913 г. было сделано около 45 определений этой величины. А. Бастелмейер (А. Beastelmeyer) опубликовал в 1919 г. результаты критического разбора всех этих работ. Как наиболее вероятное значение он дает число
e/m0 = 1,76·107 электромагнитных единиц.
В настоящее время считается наиболее достоверным число 1,769; впрочем в 1921 г. Бебкок (Н. D. Babcock) нашел число 1,761. Зная величины е из опытов Милликена и число е:m0, можно найти массу m0 покоящегося электрона. Оказалось, что
m0 = 0,8996·10-27 г, или, что масса m0 в 1810 раз меньше массы атома водорода. Мы знаем, что один грамм водорода содержит 6,062·1023 атомов. Отсюда следует, что масса электрона приблизительно равна 10-27 грамма, или что один грамм электронов содержит около 1027 электронов. О чудовищной величине заряда одного грамма отрицательного электричества можно судить по следующим данным. Сила, с которой взаимно отталкиваются два электрона, весьма мала, меняясь обратно пропорционально квадрату расстояния их друг от друга. Даже если расстояние двух электронов равно одной миллионной доле миллиметра, их взаимное отталкивание приблизительно равно одной сорокатысячной доле веса одного миллиграмма. Однако, легко вычислить, что два грамма электронов, находясь на расстоянии одного миллиона километров друг от друга, отталкиваются с силой, равной весу двадцати миллионов килограммов. Если бы один из них находился на Земле, а другой на Солнце (расстояние 150 млн. км), то сила их взаимного отталкивания равнялась бы весу 1 200 кг. Если бы один находился на Солнце, а другой на Нептуне (расстояние 4 500 млн. км), то отталкивание превышало бы вес 1 кг. Мы видели, как малы размеры электронов. Однако, 1 г электронов составляет цепь, длина которой равна 4 000 млн. км, т. е. в 28 раз больше расстояния Земли от Солнца. Заряды электрона и протона одинаковы, но их массы различны. Масса протона равна массе атома водорода. Отсюда следует, что масса протона в 1 840 раз больше массы электрона. Электроны и протоны отличаются друг от друга степенью их подвижности. Электроны чрезвычайно подвижны. Отдельные свободные электроны встречаются повсюду, например, в воздухе; огромные их количества составляют потоки электронов. Везде, где мы встречаемся с представлением о движении электричества, мы имеем дело почти только с потоками электронов. Так, например, сущность электрического тока сводится к течению электронов в проводниках. Катодные лучи, которыми пользуются для получения рентгеновых лучей, суть такие же потоки. Раскаленные тела испускают электроны. В фотоэлектрических явлениях (см. энергия) мы имеем дело с электронами. Протоны, наоборот, отличаются высокою степенью неподвижности. Они находятся в определенных местах материи, как будет изложено ниже при разборе вопроса о строении атома. Отдельные свободные протоны могут быть получены лишь в исключительных случаях. В нейтральном теле находится одинаковое число электронов и протонов. Электризация нейтрального тела всегда сводится к передвижению электронов. Положительная электризация нейтрального тела заключается в том, что часть электронов, находящихся в этом теле, переходит от него к телам соседним. Электризация при трении, например, стекла о сукно, сводится к переходу электронов от стекла к сукну (см. электричество). Наука до сих пор не открыла никаких явлений, которые заставляли бы ввести понятие о каком-либо строении электрона. В 1926 г. возникло новое учение, исходящее из представления, что все электроны весьма быстро вращаются вокруг оси, проходящей через их центр. Это вращение иногда для краткости называется «спин», от английского термина spin. Скорость вращения всегда одна и та же, но она может происходить в двух противоположных направлениях. Два электрона, оси вращения которых параллельны, могут отличаться направлением вращения.
Строение атома. Наиболее важным из научных достижений, основанных на представлении об электронах, является учение о строении атома, возникшее в 1913 г. Оно теснейше связано с учением о квантах, о квантовании, о постоянной h Планка и др. (см. энергия). В течение XIX в. химия занималась исключительно только вопросами о составе материи из молекул и молекул из атомов (см. атом). На последние наука смотрела как на однородные мельчайшие зернышки данного элемента; система (см. XXXI, 586 сл.) Д. И. Менделеева принималась как факт, но не поддавалась более глубокому разъяснению. Целый ряд явлений давно указывал, что атомы должны содержать электричество. Сюда относятся, прежде всего, явления электролиза. Не могло быть сомнения, что внутри электролита движутся по направлению к электродам отдельные атомы или группы атомов (ионы), причем одни являются носителями отрицательных электрических зарядов, т. е. электронов, а другие наэлектризованы положительно, т. е., как мы теперь говорим, потеряли электроны. Сюда же относятся многочисленные случаи ионизации газов, при которых возникают свободные электроны, несомненно, вырванные из молекул или атомов газов, остающихся в виде положительно наэлектризованных ионов. Далее можно указать на радиоактивные явления (см. радиоактивность) и на явления фотоэлектрические (см. энергия). С течением времени было предложено немало гипотез относительно строения атома или, как говорят, моделей атома. Одна из первых принадлежит лорду Кельвину (Kelvin, прежде William Thomson, 1902), который дал такую модель: атом имеет форму сферы, равномерно заполненной положительным электричеством; внутри ее находится такое количество электронов, заряд которых как раз равняется заряду самого шара, так что во внешних точках, не очень близ к его поверхности, атом должен представляться электрически нейтральным. Эта модель была затем широко разработана Дж. Дж. Томсоном (J. J. Thomson, 1910); в течение некоторого времени она пользовалась большим успехом. Дж. Дж. Томсон полагал, что лучистая энергия испускается электронами, колеблющимися внутри положительного шара. Однако, его модель не могла объяснить закономерностей в спектрах, хотя бы простейшую из них, т. е. формулу Бальмера для водорода (см. спектральный анализ, XLI, ч. 4, 57/58). В 1912 г. Резерфорд (Е. Rutherford) построил другую модель атома. По его мысли, атом состоит из ядра положительного электричества, вокруг которого вращаются электроны, подобно тому, как планеты вращаются вокруг Солнца. Ядро имеет весьма малые размеры (порядка 10—12 см), но в нем сосредоточена почти вся масса атома. Голландский ученый Вен-дер-Брек (Van der Broek) высказал мысль (1913), что число электронов, вращающихся вокруг ядра, равно порядковому числу Z элемента (см. элементы) в таблице Менделеева. Модель Резерфорда не могла объяснить возникновения, резких (тонких) спектральных линий. В 1913 г. появились три статьи датского ученого Н. Бора, основателя современного учения о строении атома. Бор всецело принимает модель Резерфорда с дополнением Ван-дер-Брека: ядро атома имеет положительный заряд, равный Z протонам, где Z — порядковое число элементов. Теория Бора подробно изложена в статье спектральный анализ (см. XLI, ч. 4, 70/76). Здесь мы к ней возвращаться не будем.
Теория Резерфорда-Бора приводит к следующему основному результату: никакой особой материи, как ее прежде понимали, нет; существует только электричество, т. е. протоны и электроны, из которых построены атомы всех элементов. В этом заключается чрезвычайное упрощение нашего мировоззрения: вместо 92-х существенно различных элементов и двух электричеств мы имеем теперь только два электричества. Мысль о превращении одного элемента в другой, теоретически говоря, перестает быть нелепой мечтой алхимиков. Возьмем, например, ртуть и золото, стоящие в таблице Менделеева рядом под порядковыми номерами 80 и 79. Атом ртути превратится в атом золота, если: 1) от внешних электронов отнять один, что весьма легко сделать, ионизируя пары ртути; 2) вырвать из ядра атома ртути 5 протонов и 4 электрона; 3) произвести внутри ядра атома ртути ту перестановку оставшихся в нем составных частей, которая, вероятно, окажется необходимой. Второе и третье мы сделать не умеем, но может быть со временем научимся.
В статье спектральный анализ подробно сказано об электронных слоях и подгруппах. Мы разовьем здесь несколько подробнее ученье о подгруппах, введем новые их обозначения и рассмотрим вопрос о постройке слоев и подгрупп. Так как общее число внешних электронов равно порядковому числу Z элемента, то ясно, что переход от одного элемента к следующему в этой таблице сопровождается добавлением одного внешнего электрона. Огромный интерес представляет вопрос о последовательной постройке слоев К, L, М и т. д., если мысленно идти вдоль таблицы Менделеева от водорода (Z=1) до урана (Z=92). Оказывается, что каждый слой предварительно построен, когда в нем находится 8 электронов. Тогда начинается постройка следующего слоя, которая, однако, в целом ряде случаев прерывается достройкой одного из нижележащих слоев. Слои М и О подвергаются одной достройке, причем число электронов в них возрастает от 8 до 18; в слое N происходят две достройки, увеличивающие число внешних электронов от 8 сперва до 18, а затем до 32. В следующей табличке указаны все эти постройки и достройки.

Каждый слой делится на подгруппы. Число подгрупп в каждом слое и число электронов в каждой подгруппе принимаются ныне согласно с выводами английских ученых Стонера и Мэн-Смита (Stoner, Main Smith), полученными в 1924 г. В следующей табличке указаны число подгрупп в каждом из слоев К, L, М и N (вторая строчка), ныне принятые обозначения этих подгрупп и число электронов в каждой подгруппе. Остальные слои (O, P и Q) даже в уране еще не окончены.

Индексы (11, 21, 22, 32 и т. д.) следует понимать как сочетания двух из чисел 1, 2, 3 и 4, между которыми следовало бы ставить запятые или черточки; мы пишем, например, 32 вместо 3,2 или 3- 2. Предполагается, что слои построены окончательно и потому общее число электронов в них равно 2, 8, 18 и 32. Та достройка внутренних слоев, которая указана в таблице 1, заключается в добавлении новых подгрупп. При первой постройке всегда возникают первые три подгруппы, содержащие 2 + 2 + 4 = 8 электронов. При достройке слоя N добавляются подгруппы N32 и N33 с 10 электронами, так что получается 18 электронов. При первой достройке слоя N возникают подгруппы N32 и N33 (10 электронов); при второй — подгруппы N43 и N44 (14 электронов), что и дает окончательно 32 электрона. Исключительно важную роль играют в атоме каждого элемента те электроны, которые находятся в наружном слое, предварительная постройка которого еще не окончена, т. е. число электронов которого не доходит до восьми. Эти электроны называются «валентными»; их число может доходить до семи. Когда наружный слой содержит 8 электронов, то есть первая постройка окончена, вовсе нет валентных электронов. От числа валентных электронов зависят, прежде всего, химические свойства элемента, а также лучеиспускание атома в инфракрасной, видимой, и ультрафиолетовой частях спектра. На наружный слой валентных электронов следует смотреть как на нечто, легко меняющееся в данном атоме. К нему относится то, что было сказано о возможных орбитах и о переходах «странствующего» электрона от одной орбиты к другой, о возбуждении атома и об испускании им лучистой энергии (см. XLI, ч. 4, 71 сл.). Не только распределение валентных электронов по возможным орбитам, но и число их в данном атоме может меняться. Это соответствует различным случаям ионизации атома; когда один или несколько валентных электронов выброшены из атома, мы имеем положительную ионизацию; когда к ним присоединяются извне прилетевшие электроны, получается ионизация отрицательная. Внутренние же слои представляют нечто твердо установившееся, готовое, лишь с трудом и при исключительных обстоятельствах подвергающееся изменениям.
В глаза бросается глубокая связь между электронными слоями К, L, М, N и периодами таблицы Менделеева. Числом валентных электронов определяется то, что в химии называется валентностью элемента. Все элементы одной вертикальной группы таблицы имеют, вообще говоря (опускаем детали), одинаковую валентность. Каждый раз, когда начинается постройка нового слоя, т. е. является один валентный электрон, мы имеем первый элемент нового периода, т. е. щелочной металл. Каждый раз, когда оканчивается первая постройка слоя и число электронов делается равным 8, а валентных электронов вовсе не оказывается, мы имеем последний элемент периода, т. е. инертный газ, в котором отсутствие валентных электронов и является причиной их химической не деятельности (инертности). Достройки усложняют дело и приводят к тому, что периоды содержат не только 8, но и 18 и 32 элемента, в полном согласии с числом электронов в слоях М, N и О. Ввиду огромной важности таблицы Менделеева мы проследим постройку всех электронных слоев в связи с возникновением периодов этой таблицы. В скобках мы ставим, рядом с химическим знаком элемента, его порядковое число Z. Период I и слой К. Имеем только 2 элемента: водород (1, H) с одним и гелий (2, Не) с двумя электронами. Этим постройка окончена, и мы имеем одновалентный водород и инертный (впрочем, не вполне) гелий. Период II (8 элементов) и слой L (8 электронов); в начале щелочной металл литий (3, Li), в конце инертный газ неон (10, Nе). Период III (8 элементов) и слой М (8 электронов при первой постройке); в начале щелочной металл натрий (11, Nа), в конце инертный газ аргон (18, Аr). Период IV (18 элементов), первая постройка слоя N (8 электронов) и достройка четвертой и пятой подгрупп слоя М (10 электронов). Сперва начинается постройка слоя N, и мы имеем щелочной металл калий (19, K) и щелочноземельный кальций (20, Са). Но начиная со скандия (21, Sc) и до никеля (28, Ni) идет достройка слоя М. От меди (29, Сu) продолжается дальнейшая постройка слоя N, которая оканчивается у инертного газа криптона (36, Kr). Период V (18 элементов). Начинается постройка слоя О у щелочного металла рубидия (37, Rb); затем идет первая достройка слоя N (подгруппы N32 и N33), которая закончена у палладия (46, Pd), и оканчивается первая постройка слоя О, которая закончена у инертного газа ксенона (54, Хe). Сложнее идет дело в периоде VI (32 элемента). Происходит постройка слоя Р от цезия (55, Cs) до инертного газа эманации (86, Еm); но она два раза прерывается внутренними достройками. Сперва окончательно достраивается слой N (подгруппы N43 и N44), в котором 6+8=14 электронов, причем получаются редкие земли от Z=58 до 71. Затем происходит еще достройка слоя О (10 электронов). Период VII не окончен. Теория Бора предсказала, что число редких земель должно равняться 14. Между тем в течение некоторого времени полагали, что их число 15, что элемент Z=72, который был назван тулий II, также принадлежит к редким землям. Однако, в 1922 г. датские ученые Костер и Хевеси (Coster и Hevesy) открыли новый элемент, который они назвали гафний (Hf). Для него оказалось Z = 72; он по химическим свойствам очень близок к цирконию и совершенно не похож на редкие земли. Это открытие представляло торжество теории Бора, правильно предсказавшей возможное число редких земель. Эта же теория объяснила также, почему в 4 местах таблицы Менделеева мы имеем более одного элемента в одной клетке, причем эти элементы химически чрезвычайно похожи друг на друга. Сюда относятся три триады: 1) Fе, Со, Ni, 2) Ru, Rh, Pd, и 3) Os, Ir, Pt и 14 редких земель, которые также надо себе представить как бы сосредоточенными в одной клетке. Отделение редких земель друг от друга представляет огромные трудности, вследствие почти полной тождественности их химических свойств. Сказанное объясняется тем, что эти элементы возникают при достройках внутренних электронных слоев. Таким образом, они отличаются друг от друга числом электронов в одном из внутренних слоев. Число же валентных электронов, от которых зависят химические свойства элемента, одинаково в каждой триаде, а также во всех 14 редких землях.
По теории Резерфорда и Бора, атом состоит из ядра, вокруг которого вращаются Z электронов, где Z — порядковое число атома в периодической системе Менделеева. До сих пор мы рассматривали почти только эти Z внешних, или планетарных электронов. Обращаемся теперь к ядру атома, которое содержит А протонов и А — Z электронов, где А — атомный вес элемента. Возникает вопрос о том, как эти составные части ядра атома в нем распределены. Предварительно нам необходимо ближе познакомиться с частицей альфа (α), выбрасываемой ядрами радиоактивных элементов (см. радиоактивность, XXXV, 333 сл.) и тождественной с ядром атома гелия. Отсюда видно, что частица альфа состоит из 4 протонов и 2 электронов. Так как масса протона в 1840 раз больше массы электрона, то оказывается, что масса частицы альфа в 7360 раз больше массы частицы бета, также испускаемой ядрами радиоактивных элементов и тождественной с электроном. Не только ядра атомов радиоактивных элементов, но ядра атомов всех элементов (кроме водорода) содержат частицы альфа; это значит, что протоны и электроны соединены в группы по 4 протона и 2 электрона, т. е. в частицы альфа, число которых наибольшее возможное для данного ядра. Атомный вес А, равный числу всех протонов в ядре, можно написать в виде А = 4n+р, где n целое число, а р = 0, 1, 2 или 3. Очевидно, n равно числу частиц альфа, а р — числу свободных протонов в ядре. Весьма важно, что в ядре атома элемента, атомный вес которого нацело делится на 4, вовсе нет свободных протонов. Скорость, с которой вылетают частицы альфа из ядер атомов радиоактивных веществ, колеблется в довольно широких пределах; в среднем она равна 0,06 скорости света. Вследствие большой, сравнительно, массы вылетевшая частица альфа обладает большим запасом кинетической энергии и потому может совершить гораздо большую работу, например большее разрушение, чем частица бета (электрон), хотя бы скорость последней равнялась 0,9 скорости света. Частица альфа представляет удивительно стойкое сооружение, которое не распадается ни при каких нам доступных условиях. Это тем более странно, что 4 протона должны были бы взаимно отталкиваться, а 2 электрона не могут их сдерживать. В настоящее время общепринято, что при очень малых расстояниях взаимное отталкивание протонов переходит во взаимное притяжение. То же самое относится и к самым частицам альфа, которые на очень малых расстояниях взаимно притягиваются. Огромная стойкость частицы альфа объясняется на основании следующих соображений. В статье энергия изложено, что энергия и масса — величины эквивалентные и что масса m может превратиться в энергию J=mc2, где с — скорость света. Если m выразить в граммах, J в эргах, то с2=9·1020. Грамм-атом гелия имеет массу 4 грамма; он образовался от «соединения» 4-х грамм-атомов водорода, из которых каждый обладает массой 1,008 (точнее 1,0078) грамма (массами электронов можно пренебречь), так что для грамм-атома гелия должна была бы получиться масса 1,008·4 = 4,03 г. Приходится допустить, что при возникновении грамм-атома гелия 0,03 г исчезли, превратившись в энергию. На основании равенства J=mc2 мы получаем, что при возникновении грамм-атома гелия выделились 0,27·1020 эргов, которые эквивалентны 300 млн. больших калорий, или 130 миллиардам кг-м работы. Такую огромную работу пришлось бы затратить, чтобы 4 грамма гелия раздробить на отдельные протоны. При образовании грамм-молекулы наиболее стойких химических соединений выделяется количество теплоты порядка 100 больших калорий, а при возникновении грамм-атома гелия это число в 3 миллиона раз больше! Во столько же раз стойкость частицы альфа больше стойкости известных нам химических соединений. Английский астроном Эддингтон (Eddington, 1923) указал, что если бы из ядер (протонов) водородных атомов, находящихся на Солнце, лишь несколько процентов соединились в ядра гелия (частицы альфа), то освободившейся теплоты хватило бы на лучеиспускание Солнца в течение миллионов лет.
Обращаемся к классическим работам Е. Резерфорда, которому впервые удалось искусственное раздробление ядер атомов некоторых нерадиоактивных элементов. Главнейшие из этих работ появились в 1919 г., а затем еще в 1921 и 1922 гг. Мы имеем здесь случай несомненного искусственного разложения атома, ибо ионизация атома представляет неглубокое и легко восстановляемое изменение его состава. Мы назовем активной такую частицу которая, двигаясь внутри газа, может вызвать ионизацию его атомов, или, попадая на поверхность флуоресцирующего экрана, вызывает на ней появление маленькой, весьма кратковременной искорки (сцинтилляции), которую удобно наблюдать при помощи лупы или микроскопа. Такими активными могут быть отдельные электроны, частицы альфа, а также, как оказалось, отдельные протоны, т. е. ионизированные атомы водорода. Длиной пробега активной частицы называется длина пути, который может пройти активная частица в данной среде от места ее возникновения до того места, где ее активность перестает быть заметной, например прекращается ионизация газа или сцинтилляция. Длина пробега частицы альфа в воздухе, находящемся под давлением одной атмосферы, колеблется, в зависимости от испускающего ее радиоактивного вещества, от 2,5 см до 8 см; в водороде она около 25 см. Частицы альфа, благодаря их большой энергии и стойкости, могут играть роль снарядов, раздробляющих атомные ядра некоторых элементов. Н. Марзден (Е. Marsden), сотрудник Резерфорда, доказал еще в 1914 г., что частицы альфа, проходя через водород, разбивают его молекулы на составные части, при чем могут возникать ионизированные атомы водорода, т. е. свободные протоны. В 1919 г. появился ряд работ Резерфорда. Во второй из них он показал, что частица альфа вырывает свободные протоны из веществ, богатых водородом, например из парафина. В четвертой он впервые сообщил миру о раздроблении ядра атома азота. Под влиянием удара частицы альфа вылетают из молекулы азота активные частицы, длина пробега которых равна 23 см. Наблюдения над движением этих частиц в магнитном поле показали с достоверностью, что это были протоны, вырванные из ядра атома азота. Так как для азота А = 14 = 4·3 + 2, то ясно, что в его ядре должны находиться по крайней мере 2 свободных протона, если остальные 12 протонов образуют 4 частицы альфа. Так как протон, выбитый из ядра атома азота, поймав один из везде блуждающих электронов, превращается в нейтральный атом водорода, то и стали тогда писать, что Резерфорд извлек водород из азота, что не вполне точно. Сущность великого открытия Резерфорда заключается в том, что он доказал наличность протонов в ядре атома азота и тем подтвердил одно из основных положений теории Бора. В 1921 г. Резерфорд сообщил, что ему удалось вырвать протоны из ядер бора, фтора, натрия, алюминия и фосфора. Атомные веса этих элементов суть числа вида 4n + 3, и только для азота 4n + 2. Любопытно, что протоны вылетают во всех случаях не только по направлению удара частицы альфа, но, особенно для алюминия, по всевозможным направлениям, даже навстречу частице альфа. Поразительным представляется еще следующий факт: энергия движения протонов, вылетающих из алюминия по направлению удара, — в 1,4 раза, а по направлению обратному — в 1,13 раза больше энергии ударяющих частиц альфа. Это заставляет думать, что по крайней мере часть энергии протона интра-атомного происхождения, а именно, что мы имеем дело со взрывом, происходящим в ядре атома, т. е. с явлением аналогичным явлениям радиоактивным, с той, однако, разницей, что из ядра атома выбрасывается протон, а не частица альфа или электрон (частица бета). Удар налетающей частицы альфа является здесь причиной этого взрыва. Шесть элементов В, N, F, Na, АІ и Р, из ядер которых Резерфорду удалось выбить протоны, имеют порядковые числа Z, равные последовательным нечетным числам от 5 до 15 (В5, N7, F9, Na11, АІ13, Р15). Интересным представляется вопрос о судьбе самой ударяющей частицы α: отскакивает ли она от атомного ядра, из которого она выбила протон, или она застревает в этом ядре? В 1927 г. английским ученым удалось наблюдать два случая несомненного застревания частицы альфа в ядре атома азота. Раздробление ядра атома происходит только в случае особенно удачного удара со стороны частицы альфа. Оказывается, что на, примерно, 10 000 ударяющих частиц альфа приходится только одна, вырывающая протон из ядра атома.
В 1923 г. начали работать над тем же вопросом венские ученые Г. Кирш и Г. Петтерсон (G. Kirsch, Н. Pettersson) с сотрудниками, Р. Голубек (R. Holoubeck) и др. Их результаты существенно отличаются от полученных английскими учеными, что привело к продолжительному спору. В первой своей работе Кирш и Петтерсон нашли, что бериллий (А=9, Z=4), кремний (А=28, Z=14) и магний (три изотопа, А = 24, 25, 26, Z=12) также подвергаются раздроблению. Правила, найденные английскими учеными, здесь не подтверждаются: все Z суть числа четные, и одно из чисел А (кремний) нацело делится на 4. В 1927 г. венским ученым удалось (по их мнению) выбить протоны из ядер атома углерода (графит и алмаз), для которого А = 12 также нацело делится на 4. Результаты, полученные для кремния и для углерода, представляются особенно сомнительными. Если бы они оказались правильными, то пришлось бы совершенно изменить наш взгляд на распределение протонов и электронов в атомных ядрах (см. ниже). В 1927 г. начали производить подобные же опыты Боте и Френц (Bothe, Franz) в Берлине. Они исследовали все элементы от бора (Z=5) до кальция (Z = 20), но могли заметить выделение протонов только в боре, азоте, магнии и алюминии. Так как магний представляет смесь изотопов, для которых А = 24, 25 и 26. вопрос о делимости на 4 здесь остается открытым. Особенно важно, что названные ученые не нашли явления в углероде (А = 12) и в кремнии (А = 28). Дальнейшие исследования (1928) по новому методу дали для бериллия, углерода и железа результаты, несогласные с выводами венских ученых, которые, однако (1929), оспаривают правильность нового метода и вновь утверждают, что из атомов углерода могут быть выбиты протоны. Нет сомнения, что все элементы от бора (Z=5) до калия (Z=19) обнаруживают рассматриваемое явление, кроме углерода (Z=6) и кислорода (Z=8). Сюда относятся, кроме вышеприведенных, еще неон, магний, хлор, аргон и калий.
Одной из важнейших задач современной физики является решение вопроса о деталях строения атомного ядра, т. е. распределения в нем А протонов и А—Z электронов. Уже было сказано, что если атомный вес вида А = 4n + p (n — целое число, р = 0, 1, 2, 3), то естественно допустить, что в состав ядра входят n частиц альфа и p свободных протонов. Из всех А—Z электронов 2n электронов входят в состав n частиц альфа, так что число х остальных электронов, не «замуравленных» внутри частиц альфа, равно
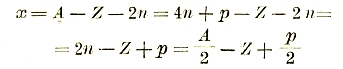
(если р нечетное, то и A нечетное). Приведем несколько примеров.
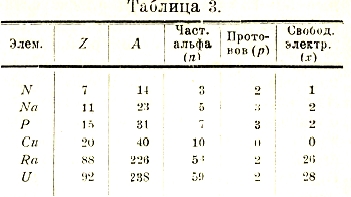
Неоднократно высказывалась мысль, что n частиц альфа скучены вместе, образуя как бы центральное ядро ядра, причем их расстояния друг от друга, а также протонов от центрального ядра таково, что они взаимно не отталкиваются, но притягиваются. Американский ученый В. Д. Гаркинс (W. D. Harkins) изучал вопрос о том, какие элементы встречаются чаще всего в земной коре и в метеоритах, полагая, что эти элементы должны обладать особенно устойчивым строением ядра. Оказалось, что 99% всей массы составлены из элементов, атомный вес которых не превышает 26 (железа); все наиболее распространенные элементы имеют четный атомный вес. Особенно же распространены элементы, атомный вес которых нацело делится на 4, и следовательно в атомном ядре совершенно отсутствуют свободные протоны, а число свободных электронов равно ½ (А—Z), как видно из формулы (7), в которой следует принять р=0. Интересные взгляды высказала выдающаяся немецкая ученая Л. Мейтнер (Lise Meitner). Она полагает, что те х электронов в ядре, которые мы назвали свободными и которые находятся в немалом количестве только в элементах двух последних периодов, в действительности же все не свободны, но присоединены по два снаружи к частицам альфа и по одному к свободным протонам, превращая их в нейтральные атомы гелия или водорода. Числа таблицы 3 показывают, что только к части имеющихся в ядре частиц альфа могут присоединиться по 2 электрона. Для ядра урана Л. Мейтнер полагает, что из х=28 электронов 2 присоединены к двум свободным протонам, а остальные 26 к 13 частицам альфа. Остальные 59—13=46 частиц альфа остаются без изменения. Понятно, что эти последние как раз нейтрализуются (для всего атома) теми 92 электронами, которые окружают ядро атома урана. Эти взгляды Л. Мейтнер встретили, однако, много возражений. Новые взгляды на строение атома стал высказывать Резерфорд, начиная с 1927 г. Он полагает, что в центре ядра находится весьма плотная масса, которая заряжена положительно; ее радиус не превышает 10-12 см. Вокруг этого центра, в области до 1,5·10-12 см, вращаются главным образом электроны. Далее, примерно до 6·10-12 см, вращаются нейтральные частицы альфа, т. е. атомы гелия. Однако, два внешних электрона находятся к ним гораздо ближе, чем в обыкновенном нейтральном атоме гелия, так как в противном случае они были бы сорваны притяжением центральной массы.
Важное значение имеет ныне вопрос о быстром вращательном движении всего ядра атома. Допущение такого движения дало возможность объяснить так называем, сверхтонкую структуру некоторых спектральных линий. Начиная с 1928 года, стали появляться замечательные теоретические исследования Г. А. Гамова (Ленинград), относящиеся, прежде всего, к вопросу о возможности вылетания частицы альфа из ядра радиоактивного атома. Переход такой частицы из области притяжения ядром в область отталкивания казался до этих работ совершенно непонятным. Исследования Г. А. Гамова дали всему вопросу о строении ядра новое направление; однако, для общедоступного изложения результатов этих очень сложных исследований еще не настало время (Г. А. Гамов, «Атомное ядро и радиоактивность», 1930).
За последнее время физика обогатилась новыми открытиями, о которых скажем несколько слов.
I. Нейтроны. Боте и Беккер (Bothe, Becker) еще в 1930 г. открыли, что бериллий под ударами частиц альфа испускает лучи, обладающие огромной проницательной способностью. Чедвик (Chadwick) первый высказал мысль, что эти лучи состоят из потока нейтронов, т. е. соединений одного протона и одного электрона. Их масса равна массе атома водорода, но их заряд равен нулю, вследствие чего они не подвергаются никаким силам со стороны атомного ядра. Частица альфа застревает в атоме бериллия, причем испускается нейтрон и остается атом углерода, согласно формуле Be (9) + α (4) = нейтрон (1) + С (12). Здесь один элемент (Be) превращается в другой (С). Бор превращается в азот: В (11) + α (4) = нейтрон (1) + N (14).
II. Позитрон. Блекет и Оккиалини (Blackett, Occhialini) в Англии и Эндерсон (С. D. Anderson) в Америке открыли положительные электроны; они отличаются от протонов тем, что их масса в 1 840 раз меньше массы протона. Заряды протона и позитрона одинаковые. Позитроны вырываются из различных атомов под влиянием космических лучей.
III. Быстрые протоны. Коккрофт и Уолтон (Kockroft, Walton) в Англии получили тонкие потоки весьма быстрых протонов. Ударяя в атом лития и застревая в его ядре, они раздробляют ядро, причем получаются два атома гелия по формуле: Li (7) + Н (1) = 2 Не (4). Фтор распадается на гелий и кислород: F (19) + Н (1) = Не (4) + О (16). Алюминий дает гелий и магний: АІ (24) + Н (1) = Не (4) + Мg (24). После Коккрофта и Уолтона еще ряд ученых получил потоки быстрых протонов. Вопрос о раздроблении атомного ядра стоит ныне в центре внимания физиков-экспериментаторов.
О. Хвольсон.
| Номер тома | 52 |
| Номер (-а) страницы | 192 |
