Элементы химические
Элементы химические. 1. Определение элементов. Все однородные вещества могут быть разбиты на две группы: простых и сложных веществ. Сложными веществами называются такие, которые могут быть разложены на менее сложные или простые вещества. Простыми же веществами являются те, которые не могут быть разложены обычными средствами на еще более простые вещества. Под обычными средствами мы разумеем воздействия теплоты, света, электрического тока на вещества и особенно взаимодействия веществ между собой. В результате многочисленных исследований удалось выделить несколько сот простых веществ, причем оказалось, что они распадаются на ряд групп; члены каждой группы физически вполне отличны друг от друга, но обладают общими химическими свойствами образовывать одни и те же химические соединения. Так, простыми веществами являются: уголь, графит и алмаз, они принадлежат к одной и той же группе, так как все они образуют одни и те же соединения, например, углекислоту, окись углерода и т. п. С другой стороны, из этих соединений можно обратно получить уголь или графит. Подобным же образом из различных сложных сернистых веществ можно выделить около десятка физически различных простых веществ, обладающих общим свойством давать одни и те же соединения: сернистый газ, серный ангидрид, сероводород; все эти простые вещества образуют группу модификаций серы. То же самое мы можем сказать и относительно различных металлов. Совокупность тождественных свойств у всех простых веществ данной группы мы приписываем объективной реальности, которую называем элементами. Согласно современным представлениям, элементы есть то общее, которое присуще данной группе простых веществ. Так, общее для группы, состоящей из угля, графита и алмаза, называется элементом углеродом. Так как из углекислоты можно выделить уголь и кислород, то мы говорим, что в углекислоте находятся элемент углерод и кислород. Подобным же образом из сложного вещества хлорного железа можно выделить простые вещества: железо и хлор, и обратно — из последних можно получить хлорное железо, по физическим свойствам ничем не напоминающее простых веществ железа и хлора; мы говорим, что хлорное железо состоит из элементов железа и хлора. Термин «железо» может обозначать или свободное, ни с чем не соединенное металлическое железо, или элемент железо в каком-либо соединении; в каком из двух смыслов употреблен данный термин, делается ясным из контекста или из обстоятельств. Железо, как элемент, проявляет себя различно в простых и сложных веществах, его свойства, как элемента, мы познаем, изучая отношения веществ друг к другу.
Итак, элемент существует в виде различных простых веществ и в виде составной части сложных веществ.
Краткого, но более конкретного и точного определения понятия элемента при современном состоянии физики и химии нельзя дать по причинам, которые выявятся в дальнейшем изложении.
2. Открытие элементов. Первое представление об элементах мы находим уже в греческой науке, но в ней под элементами разумелись не весовые и не вещественные категории. Аристотель принимал четыре элемента: землю — начало сухих и холодных свойств, воздух — начало влажных и теплых, огонь — начало сухих и теплых, и воду — начало влажных и холодных свойств. В средние века алхимики прибавили еще; ртуть — начало металлических свойств, серу — горючих, и соль — начало, сообщающее веществу вкус и способность растворяться в воде (ср. XLV, ч. 2, 292 сл.). Однако, только немногие алхимики понимали термин «элементы» в философском смысле Аристотеля; большинство смешивало его с веществами того же наименования, и таким образом в обиход вошла мысль о вещественности элементов из комбинаций которых состоят разные вещества, а отсюда и родилась мысль о возможности взаимного превращения веществ, в частности металлов, например свинца или ртути, в золото. Неудачи многочисленных попыток превращения металлов в золото постепенно приводили алхимиков к мысли, что вещества, не разлагаемые физическими и химическими средствами, суть действительные химические элементы, из которых построены сложные вещества. Эту мысль ясно высказал уже Бойль (XVII в.), но полное и отчетливое оформление она получила в конце XVIII в. в трудах Лавуазье. Постепенно список элементов химических, как результат многовекового опыта по разложению веществ, увеличивался, но в этом списке наряду с вещественными сохранились и невещественные элементы: материя света, теплоты, флогистон («сера» алхимиков). Лавуазье признавал 35 элементов, кроме ряда общеизвестных металлов: кислород, азот, водород, серу, фосфор, углерод, затем едкие натр и кали, а также светород и теплород. После Лавуазье химия, нашедшая правильную дорогу, быстро стала увеличивать число элементов. Первым методом открытия элементов химических был анализ минералов, причем критерием нового элемента было обнаружение дефицита в количественном анализе тела, а затем выделение вещества с новыми реакциями. Конечный этап в работе — выделение нового элемента в виде простого вещества - необязателен для установления его; в некоторых случаях промежуток времени между несомненным установлением нового элемента и выделением его в виде простого вещества измерялся десятками лет; так, фтор в виде соединений был открыт Ампером в 1810 г., но впервые выделен как таковой только в 1886 г. Муассоном. Этот момент сказался также в том, что, с одной стороны, некоторые соединения долгое время принимались за элементы (окиси щелочных металлов), с другой стороны — некоторые простые вещества считались окислами неизвестных элементов (азот — окислом «нитрикума», хлорокислом «мурия»).
Путем химического анализа было открыто более половины ныне известных элементов; дальнейшие открытия новых элементов стали возможными только после введения в химическую практику новых физических методов; так, с помощью электрического тока были выделены калий, натрий, кальций, стронций и барий. К 1830 г. уже было установлено 56 элементов, с 1830 по 1861 г. можно отметить только предварительное открытие лантана, тербия и эрбия. Новый физический метод — спектральный анализ — с 1861 г. дал мощный способ открытия элементов, уже к 1863 г. им были открыты рубидий, цезий, талий и индий; все последующие изыскания новых элементов оперируют со спектроскопом, а в области элементов редких земель спектроскоп является настольным инструментом, регулирующим всякую работу в этой, области.
С 1863 по 1894 г. вне группы редких земель были открыты только два новых элемента: галлий (1875) и германий (1886).
Следующее открытие группы инертных газов являлось результатом приложения уточненных методов определения плотностей газов к воздуху и азоту; первым был открыт аргон (1894), вторым гелий (1895), затем неон, криптон и ксенон (1898). Открытие радиоактивности привело к новым радиоактивным элементам (с 1898 г.). Последний метод, которым пользуются ныне и который является универсальным, состоит в изучении рентгеноспектрограмм (см. ниже). Долгое время открытие элементов было делом случая, так как не было никаких указаний на возможное число и порядок элементов. Два теоретических открытия — периодической системы элементов (см. XXXI, 586 сл.) и закона Мозли о распределении линий в рентгеновском спектре (см. XLI, ч. 4, 66) — поставили поиски элементов на научную базу (см. ниже).
3. Эквивалентные и атомные веса. Введение в химию понятия об элементах и изучение однородных сложных веществ, как соединений элементы, сразу привело к самому замечательному закону химии — закону постоянства состава: «Во всяком образце данного сложного вещества весовые отношения составных частей (элементов) всегда оказываются одними и теми же» (ср. XLV, ч. 2, 298). Определения весовых отношений, в которых элементы входят в состав различных соединений, показали, что два элемента могут соединяться в нескольких отношениях, т. е. что существуют группы соединений, различающиеся весовыми отношениями элементов, входящих в состав, причем в каждой группе эти отношения постоянны. Так, в состав воды входят водород и кислород в отношении 1,008:8, а в состав перекиси водорода в отношении 1,008:16; азот и кислород образуют пять соединений, в которых на 14 весовых частей азота приходится соответственно 8, 16, 24, 32, 40 частей кислорода. Факты, аналогичные последнему, привели к установлению Дальтоном закона кратных отношений: «Если два элемента образуют друг с другом два или несколько соединений (в различных отношениях), то с одним и тем же количеством одного из них соединяются такие количества другого, которые между собой находятся в простых кратных отношениях» (ср. XLV, ч. 2, 301). Последний закон привел к созданию Дальтоном атомистической гипотезы (см. IV, 262/63) согласно ей отношения, в которых соединяются элементы, сводятся к отношениям весов атомов этих элементов; из таких отношений нельзя, конечно, вычислить абсолютные веса атомов, но можно было вычислить относительные их веса, которые и были названы атомными весами элементов. Для их вычисления надо было взять один из элементов в качестве стандартного и вес его атома приравнять единице; в качестве такого был взят первоначально водород, как наиболее легкий из них. По первым, недостаточно точным, опытам было найдено, что атом кислорода тяжелее атома водорода в 16 раз. Впоследствии точные исследования показали, что атом кислорода тяжелее атома водорода в 15,87 раз. Так как с кислородом, как с газом, легче работать, нежели с водородом, и так как кислород образует значительно больше прочных соединений, доступных точному анализу, нежели водород, то в качестве стандартного элемента ныне принимается кислород, и вес его атома принимается условно за 16. Однако, в первую половину XIX в., несмотря на введение понятия атома, и атомного веса, оказалось невозможным установление определенных значений атомных весов для различных элементов. Так, азот дает пять соединений с кислородом, в каждом из них на одно и тоже количество кислорода приходятся различные количества азота; какое же из этих значений принять за атомный вес азота? Установление Гей-Люссаком объемного закона при соединениях и разложениях газообразных веществ (см. XLV, ч. 2, 302/03) в не которых случаях помогло в выборе атомного веса того или другого элемента, но далеко не во всех случаях. Поэтому долгое время в химии играли выдающуюся роль не атомные веса, а эквивалентные веса (или эквиваленты), установление численных значений которых не требует никаких теоретических предпосылок относительно строения вещества.
Эквивалентным весом, или эквивалентом элемента, называется то количество его, которое соединяется или замещает 1008 частей водорода или 8 частей кислорода. Очевидно, что элемент в общем случае имеет несколько эквивалентных весов; так, у азота эквивалентные веса равны: 14; 7; 4,67; 3,5 и 2,8; у углерода: 3,6 и 12, и т. д. Для решения многих практических задач достаточно знание только эквивалентов, но для развития химии необходима была атомистическая химия, а, следовательно, и понятие об атомном весе как единственной количественной характеристике элементов, в противоположность эквивалентным весам — в общем случае множественной характеристике.
Уже в 1811 г. была высказана гипотеза, которая давала однозначное решение вопроса о выборе атомного веса элементы из числа эквивалентных весов его; это была гипотеза Авогадро, согласно которой при одинаковых температуре и давлении в равных объемах различных газов содержится одинаковое число частиц. Гипотеза Авогадро в течение долгого времени не могла войти в обиход химии, так как она оказывается неверной, если под частицами вещества разуметь атомы. Плодотворной она могла стать только после того, как было введено понятие о молекуле и было проведено строгое различие между атомом и молекулой.
Молекулой называется наименьшее количество вещества, которое физически может существовать как специфическое качество и реагировать как таковое. Атомом же называется наименьшее количество элемента, входящее в состав молекул его соединений. В качестве весовой единицы атомов и молекул принимается 1/16 часть веса атома кислорода, отсюда атомным весом элемента называется число, показывающее, во сколько раз атом данного элемента тяжелее 1/16-ой части веса атома кислорода, а молекулярным весом вещества называется число, показывающее, во сколько раз молекула данного вещества тяжелее 1/16-ой части веса атома кислорода.
Так определенные атомные и молекулярные веса называются относительными в отличие от абсолютных, указывающих вес атома или молекулы в граммах (см. ниже). Гипотеза Авогадро становится верной, если под частицей разуметь молекулу. Однако, даже после введения в химию понятия о молекуле гипотеза Авогадро не могла занять надлежащего доминирующего положения, т. е. не могла сразу превратиться из гипотезы в закон, по двум веским причинам: эта гипотеза не оправдывалась на некоторых отдельных соединениях, подобных хлористому аммонию NH4Сl или пятихлористому фосфору РСl5,и не оправдывалась на простых газообразных веществах, как водород, кислород, хлор, азот и т. д. Для полного торжества гипотезы Авогадро необходимо было сделать трудное допущение о молекулах, состоящих из одинаковых атомов, например Н2, О2, N2, Cl2 и т. д., что противоречило электрохимическим воззрениям, идущим от Берцелиуса; кроме того, надо было дождаться развития Сен Клер Девиллем учения о диссоциации (см. XVIII, 411 сл.). С этого времени гипотеза Авогадро превратилась в основной закон химии, позволяющий во всех тех случаях, когда элемент дает летучие соединения, однозначно определять его атомный вес.
Берем в качестве стандартного газа кислород и принимаем, что его молекула состоит из двух атомов O2 и что, следовательно, его молекулярный вес 32; если мы станем определять плотности других газов и паров по отношению к кислороду, то из закона Авогадро тотчас же следует основная теорема химии: молекулярный вес М данного соединения равен плотности его пара Δ по отношению к кислороду, помноженному на 32: М = 32Δ. В прежнее время в качестве стандартного газа брали водород, плотности газов и паров определяли по отношению к воздуху, но перечисляли их в отношении водорода (В); принимая молекулярный вес водорода в первом приближении равным 2, получали, что молекулярный вес соединения М=2D.
Если мы знаем молекулярный вес соединения и его количественный состав, то всегда сможем рассчитать относительные количества элементов, входящие в молекулу данного вещества. Например, плотность метана Δ=0,501, следовательно, его М=16,033; в метане на 1,008 частей Н приходится 3 части углерода, отсюда в молекулярном количестве его (16,032) содержится 4,032 части Н и 12 частей углерода. Аналогичные расчеты показывают, что в молекулярных количествах этилена содержится 4,032 части Н и 24 части С, а в случае бензола 6,048 части Н и 72 части С. Исследование большого числа углеродистых соединений показало, что наименьшее количество углерода, входящее в состав их молекул, равно 12, следовательно атомный вес углерода 12.
Таким образом количественный анализ соединений данного элементы дает его эквивалентные веса в разных соединениях; для того чтобы от эквивалентов перейти к атомному весу элементов, главнейшей количественной характеристике его, надо определить плотность паров его соединений и, опираясь на закон Авогадро, вычислить молекулярные их веса; анализ полученных данных позволяет однозначно определить искомый атомный вес.
Однако, не все элементы образуют летучие соединения, удобные для точного определения их плотностей. В этих случаях исторически пришлось воспользоваться другими законами, чтобы от эквивалентов перейти к атомному весу. Таких законов три: закон Дюлонга и Пти (см. XIX, 349), закон изоморфизма Митчерлиха (см. XXV, 613 сл.) и периодический закон Д. И. Менделеева (см. XXXI, 586 сл.). Так как произведение из атомного веса на теплоемкость простого вещества есть величина приблизительно постоянная, равная в среднем 6,4, то путем деления этого числа на теплоемкость простого вещества мы найдем приблизительное значение атомного веса, которое покажет нам отношение атомного веса к эквивалентам; а так как это отношение должно быть целым числом, то, округлив найденное значение отношения и умножив его на точное значение эквивалента, мы найдем точный атомный вес искомого элемента. Этот путь сыграл скромную роль в истории по трем причинам: для самого установления закона Дюлонга и Пти надо было для ряда элементов предварительно знать атомный вес их, затем этот закон неприложим к легким элементам и, наконец, ряд элементов или не был известен в виде простых веществ, или не мог быть получен в виде достаточно чистых простых веществ.
Закон изоморфизма сыграл исторически важную роль. Тот факт, что соли серной и хромовой кислоты изоморфны, привел к исправлению формул окислов хрома, железа и других элементов, а вследствие этого и к более правильному определению атомных весов их еще задолго до использования для этой цели закона Авогадро.
Окончательную роль в правильном установлении атомных весов элементы сыграл периодический закон Менделеева и основанная на этом законе таблица элементов.
До сих пор мы говорили об относительных атомных весах, что же касается абсолютных атомных весов, то только в XX столетии ряд физических и физико-химических методов привел к точным определениям их (например, опыты Перрена; см растворы, XXXV, 670). Оказалось, что единица атомных и молекулярных весов = 1/16 веса атома кислорода, в абсолютных весах весит 1,6490·10-24 г, атом водорода (Н = 1,0078) — 1,662·10-24, атом гелия (Не = 4,00216) — 6,5994·10-24. Абсолютные веса других элементов мы можем вычислить умножением веса 1/16 О на атомный вес элементов.
4. Периодическая система элементов и изотопы. В статье периодическая система (см. XXXI, 586/96) указана история открытия этой системы, ее классификационная ценность и ее роль в правильном установлении атомных весов ряда известных элементов и даже в предсказаниях новых элементов и их свойств. Там же приведена самая таблица элементов в том виде, какой ей окончательно дал Д. И. Менделеев. Несмотря на все достоинства этой таблицы, в ней мы находим ряд ставящих нас в тупик моментов, из которых укажем на три. В трех парах (аргон и калий, кобальт и никель, теллур и йод) элементы следуют друг за другом в порядке убывания атомных весов, между тем как вся таблица построена на идее расположения элементов по возрастающим атомным весам. Далее, группа элементов редких земель лантанидов, т. е. элементов, следующих за La до Ta, совершенно не укладывалось в систему элементов; эта трудность сказалась на построении таблицы (см. XXXI, 589/90), где показаны только La, Ce, Yb и вставлен пустой 9-й ряд. Наконец, необъясненным оставался факт попадания совершенно отличных элементов в одну и ту же группу, как, например, марганца в группу галоидов, меди, серебра и золота в группу щелочных металлов, и вообще факт различия между четными и нечетными рядами. Все эти моменты делали то, что, несмотря на все положительные стороны периодической системы элементов, многие крупнейшие ученые в лучшем случае смотрели на эту систему не как «на закон природы в строгом смысле слова», а как на «принцип классификации чего-то не вполне определенного» (Оствальд, 1900). Нужно было развитие новых глав физики и химии для того, чтобы убедиться в том, что периодический закон Д. И. Менделеева есть «закон природы в строгом смысле слова». Такими новыми главами явились учения о радиоактивности, об изотопии и о строении атома.
Изучение радиоактивности привело к открытию целого ряда (около 40) новых радиоактивных элементов, располагающихся по своим атомным весам и химическим свойствам между свинцом (207, 22) и ураном (238, 17), т. е. около 40 элементов приходится на 11 клеток, из которых 4 заняты были известными элементами: Pb, Bi, Th и U. Одновременно выяснилось, что эти радиоэлементы мoгyт быть разбиты на группы (плеяды), характеризующиеся тем, что члены одной и той же группы обладают тождественными химическими свойствами и, если они находятся в смеси, то никакими химическими путями не могут быть разделены; их разделение происходит только самопроизвольно в силу различной продолжительности их жизни. Примерами могут служить ториевый и радиевый свинцы, радий и мезоторий 1, торий и ионий (см. радиоактивность). Содди (см. XLVIII, прил. современные деятели науки, 20) предложил поместить радиоэлементы с тождественными химическими свойствами в одну и ту же клетку периодической системы и назвать члены одной и той же группы изотопами (с греческого, «занимающие одно и то же место»). Изотопы радиоэлементов могут различаться атомными весами, а так как химически они неотделимы, то смесь их ведет себя как единый химический элемент. Если каждый из элементов обладает атомным весом, выражаемым целым числом, то смесь их может иметь атомный вес, заметно уклоняющийся от целого числа. Отсюда рождается мысль, не являются ли смесями изотопов и обыкновенные элементы, по крайней мере те, атомные веса которых не выражаются целыми числами.
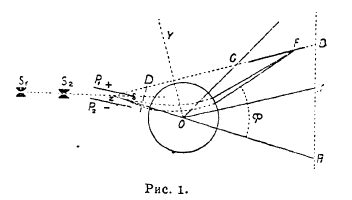
Рис. 1.
Путем изучения каналовых лучей Астону (см. XLVIII, приложение современные деятели науки, 18) и Демистеру удалось дать вполне положительный ответ на этот вопрос. Каналовые лучи получаются в разрядных трубках в направлении, обратном направлению катодных лучей, и через каналы в катоде могут быть направлены в пространство позади катода; каналовые лучи состоят из быстро движущихся положительно заряженных газовых частиц (атомов, радикалов, молекул). В приборе Астона положительные лучи, пройдя через продырявленный катод, направляются через щели S1 и S2 (рис. 1), откуда в виде пучка параллельно идущих частиц попадают в электрическое поле между пластинками Р1 и Р2. Пусть е – заряд частицы, m – ее масса, а v – скорость; частицы каналовых лучей обладают различными значениями отношения e/m и различными скоростями, а поэтому они различно отклоняются в электрическом поле. Так, группа частиц с определенными значениями e/m и v меняет свое направление S1S2Z в новое направление ZOA. Выйдя из электрического поля, лучи попадают в магнитное поле между двумя дискообразными полюсными якорями О; направление магнитного поля таково, что направление отклонения лучей противоположно отклонению в электрическом поле, но в то время как в последнем отклонение пропорционально e/mv2, в магнитном поле оно пропорционально e/mv, в результате чего частицы, разделенные электрическим полем, собираются вновь магнитным полем, но так, что на фотографической пластинке GF сходятся вместе частицы с одинаковым значением e/m (например, на рис. точка F). Частицы с различными значениями e/m оставляют на пластинке разрозненные следы (рис. 2). Мерой значений e/m являются следы известных атомов и молекул, например, О2, О, СО, СО2 и т. д. Получаемые этим способом следы разных частиц называются «спектрами масс», а самый прибор Астона — масс-спектрографом.

Рис. 2.
Для элементов, не образующих газообразных соединений, применяется другой прибор (Демпстер); нелетучие вещества наносятся на анод трубки, особо устроенный, и затем или сильно нагреваются электрическим путем, или подвергаются «обстрелу» катодными лучами; в остальном идея способа – прежняя.
В настоящее время изучено подавляющее большинство элементов, причем оказалось, что многие из них действительно представляют собой смеси изотопов; в прилагаемой таблице 1 приведены результаты опытов к 1931 г. Таким образом нецелочисленность атомных весов многих элементов находит себе объяснение в явлении изотопии.
В связи с этими явлениями возникает вопрос, должны ли мы называть элементом каждый изотоп, или же элементом является сущность плеяды изотопов. Исходя из химической точки зрения, более верным будет второе положение; изотопы суть разновидности элементов; элементы же делим на чистые, состоящие из атомов только одной разновидности, и смешанные, состоящие из атомов нескольких разновидностей.
1. Таблица атомных весов.

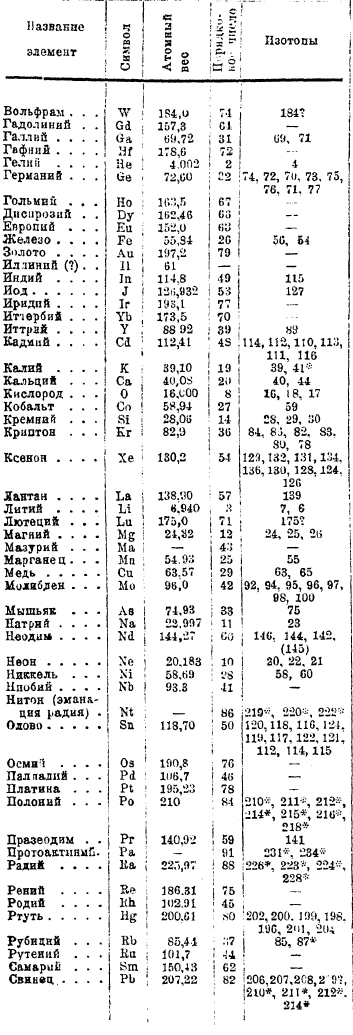
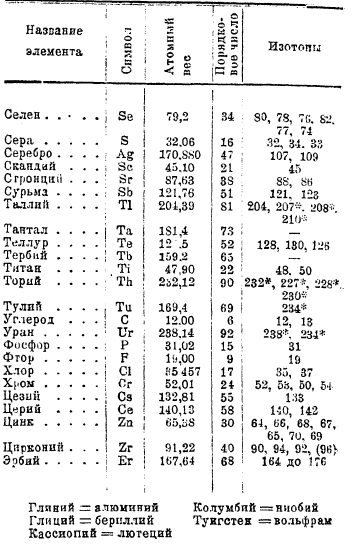
Цифры c * относятся к радиоактивным изотопам.
Первые исследования Астона показали, что атомные веса изотопов целочисленны, последние же исследования с новопостроенным масс-спектрографом большей силы отчетливо дали определенные уклонения от целых чисел; о смысле этих уклонений мы будем говорить ниже. Заметим, что в настоящее время найден еще один способ нахождения изотопов и определения с исключительной точностью отношения масс изотопов данного элемента; этот способ состоит в анализе вибрационных спектров молекул; так, разные атомы хлора Сl35 и Сl37 могут образовать разные молекулы хлора Сl2 (изотопные молекулы Cl35, Cl35, Cl35, Сl37, Cl37, Сl37); в полосатом спектре полосы, обязанные своим существованием вибрациям атомных ядер, получают расщепление, из величины которого можно вычислить отношения масс изотопов. Таким путем были подтверждены изотопы, найденные раньше масс-спектрографом, и открыты новые редкие изотопы, например изотопы кислорода О17 и О18, углерода С13, азота N15, хлора Сl36 и, наконец, водорода Н1, Н2, H3. Наиболее важным является открытие изотопов кислорода, стандартного элемента; к счастью, количественно примеси изотопов О17 и О18 очень малы, а именно — О16:О17: О18 — 10000:1:8, что, впрочем, требует дополнительных определений. Следовательно, если мы примем О16=16,0000, то атомный вес обычного кислорода 16,0017 (по Меку даже 16,0035). В дальнейшем мы будем принимать в учении об атоме (но не в химии) за единицу атомных весов 1/16 часть веса изотопа О16.
Изотопы различаются атомным весом; различий между свойствами изотопов и их соединений можно ожидать только в случае тех свойств, которые являются функциями атомного веса; в тесной связи с этим стоит вопрос о разделении изотопов. В многочисленных опытах более чем десятью способами (фракционированная перекристаллизация, действие центробежной силы, диффузия, перегонка и т. д.) в лучшем случае удалось достигнуть весьма незначительного обогащения, пока, наконец, Герцу не удалось сконструировать остроумный прибор для диффузии газов через пористые трубки; этим путем ему удалось разделить изотопы неона.
Полное разделение удалось также и в случае водорода; изотопы Н1 и Н2 сильно разнятся по своему атомному весу (1 и 2), что облегчает разделение их методом испарения жидкого водорода или путем электролиза воды, в остатке которого остается так называемая тяжелая вода H22O; изотоп Н2 получил отдельное название дейтона (D2 = Н2).
Весьма существенный факт, что сметанные элементы, независимо от географического нахождения, геологического и даже космического (метеориты) происхождения исходных веществ и способа выделения и анализа элементы, всегда при самых точных опытах показывают один и тот же атомный вес. Исключение составляет один только свинец, который в зависимости от происхождения (обыкновенный и два радиоактивного происхождения) обладает различными атомными весами. Но обыкновенный свинец, независимо от происхождения, всегда дает один и тот же атомный вес. Этот факт говорит против предположения, что обыкновенные элементы являются конечными продуктами распада радиоактивных элементов, более тяжелых, чем уран, и распавшихся еще в период времени до отвердения Земли. Почти математического точного смешения изотопов нельзя себе представить в системах, подобных туманностям и огненно-жидким небесным телам; гораздо вероятнее предположение, что синтез элементы во вселенной идет так, что образуются одновременно изотопы в определенных соотношениях (см. ниже).
5. Порядковое число. Вещества, будучи подвергнуты действию катодных или рентгеновых лучей, испускают рентгеновы лучи, которые могут быть разложены в спектры, характерные для элементов, составляющих данное вещество; характеристический рентгеновский спектр элемента проще его оптического спектра и состоит из отдельных групп линий; группы обозначаются буквами К, L, М и N, линии же в группе обозначаются греческими буквами (например, Кα, Lα, Lβ и т. д.). Длины волн однородных лучей в каждой группе уменьшаются с ростом атомного веса элемента; так, линия Кα для Na равна 11,8836 · 10-8, а для W - 0,21352 · 10-8. Мозли (см. XLVIII прил. деятели науки, 17), систематически изучивший рентгеновские спектры различных элементов, открыл замечательный закон, носящий его имя (см. спектральный анализ, XLI, ч. 4, 66/69). Если мы обозначим через λ —длину волны, через α — постоянную, через Z — порядковое (целое) число, то для однородных лучей разных элементы закон Мозли имеет вид: 1/λ = а (Z— 1)2 причем для водорода Z = 1, а для гелия Z = 2; таким образом, каждый элемент получает свой номер Z, называемый чаще порядковым числом его. Уравнение Мозли может быть переписано так
26, если обозначим 27 через х, то 28, следовательно, порядковое число есть линейная функция от х, т. е. от квадратного корня из величины, обратной длине волны (1/λ). Таким образом, длины волн в характеристическом рентгеновском спектре элементов не являются периодической функцией ни от атомного веса, ни от порядкового числа их (из других свойств не периодической функцией является теплоемкость). Порядковое число свойственно элементам, но не изотопам.
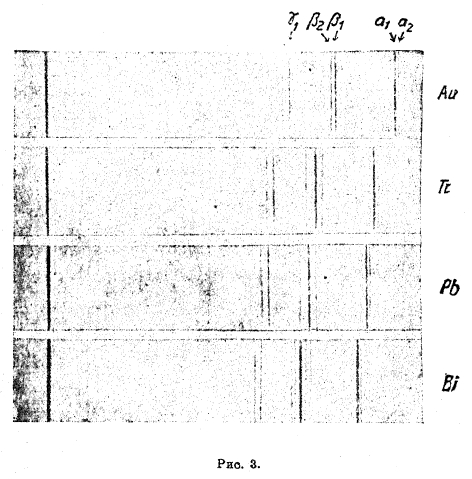
Рис. 3
Таблица Д. И. Менделеева
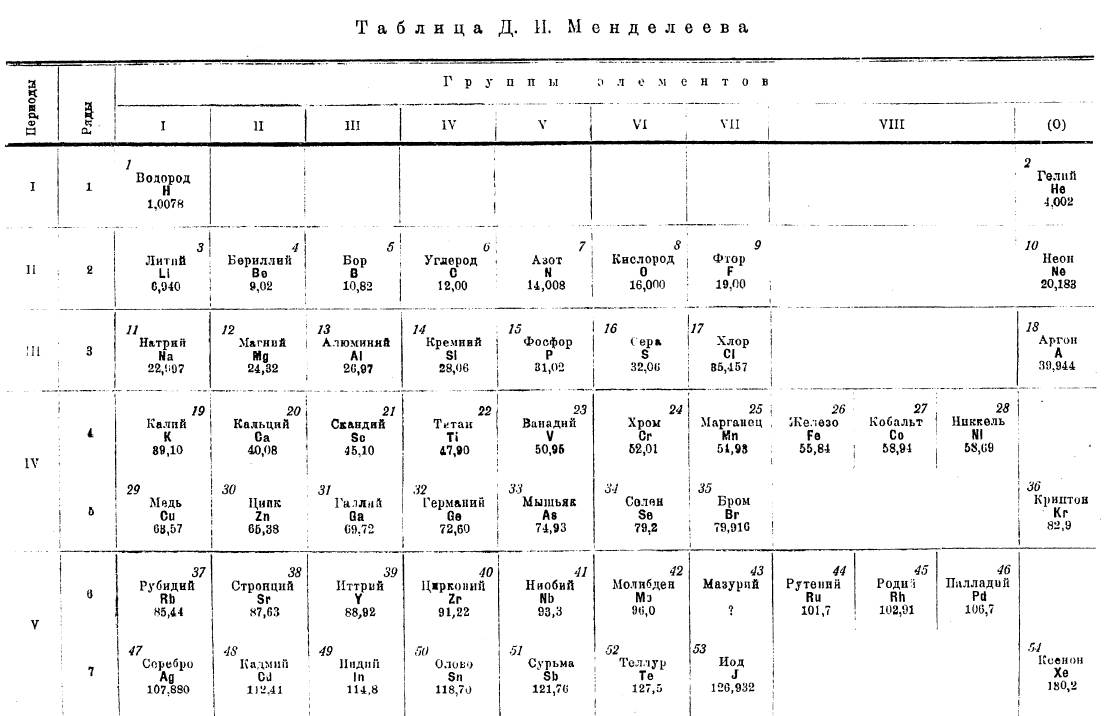
Закон Мозли, дающий однозначный ответ о порядковом числе элемента, решает ряд крупнейших проблем химии, в том числе вопрос об окончательном установлении периодической системы элементов. В таблице Д. И. Менделеева (см. XXXI, 589/90) незнание общего числа элементов редких земель привело к неполным 8, 9 и 10 рядам, чем и была нарушена стройность системы. Закон Мозли показал, что порядковый номер бария 56, а тантала 73, следовательно, между барием и танталом может быть только 16 элементов. Этот же закон доказал правильность всей конструкции периодической системы элементов, правильность расстановки А, К, Со, Ni, Те и J, законность попадания Мn в группу галоидов и т. д. На основании закона Мозли можно придать системе элементов окончательный вид (таблица на стр. 431/34). Пользуясь рентгено-спектрограммами, было показано, что химией действительно не были открыты элементы с порядковыми числами 43, 61, 72, 75, 85 и 87.
Рис. 3 показывает, как правильно смещаются однородные линии (α, β, γ группы L) рентгеновского спектра с изменением порядкового числа элементов; здесь же легко увидеть по ненормальному смещению этих линий, что между золотом; и таллием не хватает одного элементf (ртути). Рентгеновский спектр и закон Мозли являются наиболее совершенным средством к открытию новых элементов; так были открыты элементы мазурий (43), иллиний (61) (?), гафний (72), peний (75).
По закону Мозли в указанной выше форме в системе элементов нет места таким элементам, как короний, небулий и геокороний, существование которых предполагалось на основании наличия особых линий в спектрах солнечной короны, некоторых звезд и северного сияния. В настоящее время известно (Боуэн), что эти линии принадлежат обычным элементам: кислороду, азоту, аргону, атомы которых находятся в особом состоянии возбуждения.
Закон Мозли доказал правильность периодической системы элементов с многими ее особенностями, но не может, конечно, объяснить эти особенности; последняя задача в значительной степени решена теорией атома.
6. Теория атома и химические элементы (см. электронная теория). Со времени открытия спектрального анализа стало ясным, что атом не простой комочек вещества, а что он обладает сложной структурой. Сложность спектров и их «мистическая» арифметика долгое время были совершенно недоступны для объяснений; только развитие электронной теории, учения о радиоактивности и учения о квантах энергии впервые в руках Н. Бора (1913; см. XLVIII, приложение деятели науки, 13) дали ключ к пониманию спектров, а через них и к строению атомов (см. XLI, ч. 4, 70 сл.). Центральной идеей для теории атома является вывод Резерфорда (см.) из опытов прохождения α-частяц (иона Не++) через различные вещества: вещество атома главным образом сосредоточено в чрезвычайно малом объеме в виде ядра, несущего положительные заряды; вокруг ядра имеются отрицательно заряженные элементы с ничтожной массой, но своими зарядами уравновешивающие заряд ядра так, что в целом атом нейтрален. Теория Дж. Дж. Томсона (см.), по которой положительный заряд атома распределен по сфере, внутри которой находятся электроны в определенной конфигурации, не выдержала опытной проверки и должна была уступить место идее Резерфорда (см. электронная теория, LII, 198 сл.). Возможно двоякое использование этой идеи: статическое (Штарк, Льюис, Лангмюир) и динамическое (Н. Бор). С первой точки зрения электроны, расположенные вокруг ядра, неподвижны, в лучшем случае испытывают колебания; какими силами они удерживаются от падения на ядро, неизвестно; существование таких сил теория постулирует. Статическая теория атома смогла качественно объяснить ряд химических свойств элементов, но даже и для качественного объяснения она оказалась слишком громоздкой и вследствие этого очень мало плодотворной; с точки зрения количественного учета она оказалась непригодной и в химии, и в физике. Динамическая теория Н. Бора исходит из допущения, что электроны движутся вокруг ядра наподобие планет, обращающихся вокруг Солнца. Однако, электрон, как заряженное тело, при вращении должен терять энергию и раньше или позже упасть на ядро. Бор постулирует, что в атоме есть ряд определенных орбит, двигаясь по которым электрон не теряет энергии, а следовательно, может двигаться вечно. Такие орбиты называются квантованными и вычисляются на основании теории квант (см. энергия). Электрон излучает или поглощает энергию при перескоках с одной квантованной орбиты на другую. Количественный учет энергии, освобождающейся при таких перескоках электрона, дает ключ к пониманию спектров; расшифровка спектров — огромнейшая заслуга теории Бора. В первоначальной теории электронные орбиты предполагались круговыми, радиус квантованных кругов
![]()
где h — квант действия (6,55·10-27 эрг. сек), μ — приведенная масса ядра и электрона (μ=Mm/(M+m)), M – масса ядра, m — масса электрона, Z — порядковое число элемента, n — главное квантовое число, могущее быть только целым числом 1, 2, 3, …∞. Зоммерфельд расширил теорию Бора, введя эллиптические орбиты, вместе с тем появилось новое, побочное или азимутальное квантовое число k. Эллипс характеризуется большой и малой полуосями; выражение для большой оси получилось тождественным с выражением для радиуса круговой орбиты Бора, выражение же для малой полуоcи имеет вид:
![]()
из свойств эллипса вытекает, что k не может быть нулем или быть больше n, следовательно k = 1, 2, 3,... n. Таким образом, мы получаем группы орбит в зависимости от значений n и k, обозначаемые символом nk. При n = 1, k = 1 возможна только одна круговая орбита 11; при n = 2 возможны орбиты: 21 - эллиптическая и 22 — круговая; при n = 3 возможны орбиты 31 и З2 — эллиптические и З3 — круговая, ибо при n = k, а = b, и т. д. Рис. 4 показывает ряд первых возможных орбит электрона по теории Зоммерфельда.
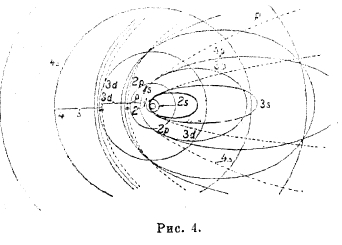
Рис. 4
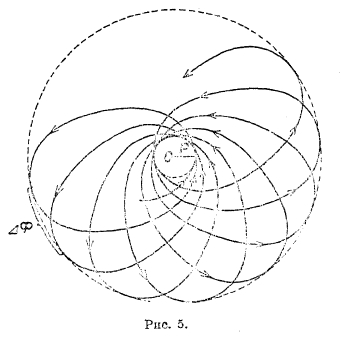
Рис. 5
Оказалось, однако, что энергия электрона зависит по этой теории только от главного квантового числа n и не зависит от значения k, а так как свойства атома определяются энергиями электронов, то очевидно, что введение эллиптических орбит и нового квантового числа не продвигает нас дальше первой теории Бора. Положение изменяется, если мы учтем то, что электрон движется с огромной скоростью и в случае эллиптической орбиты — с непостоянной скоростью; в области афелия он движется медленнее, нежели в области перигелия следовательно, масса электрона непостоянна если m0 — масса покоящегося электрона, v — скорость электрона, с — скорость света, то масса движущегося электрона 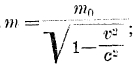 ; очевидно, что при переменной скорости v переменна и масса m.
; очевидно, что при переменной скорости v переменна и масса m.
Уравнение эллипса в полярных координатах ![]() , где r — радиус-вектор, φ — полярный угол, а — большая полуось, ε — эксцентриситет эллипса. Если мы учтем непостоянство массы электрона, то для орбиты электрона получим уравнение
, где r — радиус-вектор, φ — полярный угол, а — большая полуось, ε — эксцентриситет эллипса. Если мы учтем непостоянство массы электрона, то для орбиты электрона получим уравнение ![]() , где γ — коэффициент, мало отличающийся от единицы. Рис. 5 доказывает вид кривой, отвечающей этому уравнению; на такую розетку можно смотреть как на эллипс, вращающийся в своей плоскости, причем ось вращения проходит через фокус, где находится ядро. Дуга Δφ, измеряющая расстояние между двумя последовательными положениями афелия, зависит от
, где γ — коэффициент, мало отличающийся от единицы. Рис. 5 доказывает вид кривой, отвечающей этому уравнению; на такую розетку можно смотреть как на эллипс, вращающийся в своей плоскости, причем ось вращения проходит через фокус, где находится ядро. Дуга Δφ, измеряющая расстояние между двумя последовательными положениями афелия, зависит от 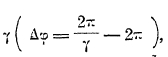 , а γ в свою очередь зависит от k, вместе с тем и энергия электрона зависит от k. В данной интерпретации квантовое число к характеризует собою вектор-момент вращения орбиты электрона. Теория Зоммерфельда позволила, с одной стороны, подойти к объяснению тонкой структуры спектра водорода, с другой — разбить электронные орбиты на группы, характеризующиеся числом n и подгруппы, характеризующиеся числом k, что открыло дорогу к выяснению строения атомов других элементов и смысла периодической системы. Однако, ни одной из этих задач нельзя было решить до конца; спектры элементы оказались значительно сложнее, и для их дальнейшего объяснения потребовалось введение новых квантовых чисел. Теоретически задача оказалась настолько сложной, что новые квантовые числа были введены эмпирическим путем, и далеко не сразу удалось им дать удачное физическое толкование. Крупным успехом в теории атома оказалась гипотеза Юленбека и Гаудсмита, приписавшая электрону собственное вращение с механическим моментом (вектором) s = ½ (в единицах h/2π). Вместе с тем пришлось ввести вместо квантового числа k число l = k—1; таким образом, числом может принимать значения 0, 1, 2.... (n—1).
, а γ в свою очередь зависит от k, вместе с тем и энергия электрона зависит от k. В данной интерпретации квантовое число к характеризует собою вектор-момент вращения орбиты электрона. Теория Зоммерфельда позволила, с одной стороны, подойти к объяснению тонкой структуры спектра водорода, с другой — разбить электронные орбиты на группы, характеризующиеся числом n и подгруппы, характеризующиеся числом k, что открыло дорогу к выяснению строения атомов других элементов и смысла периодической системы. Однако, ни одной из этих задач нельзя было решить до конца; спектры элементы оказались значительно сложнее, и для их дальнейшего объяснения потребовалось введение новых квантовых чисел. Теоретически задача оказалась настолько сложной, что новые квантовые числа были введены эмпирическим путем, и далеко не сразу удалось им дать удачное физическое толкование. Крупным успехом в теории атома оказалась гипотеза Юленбека и Гаудсмита, приписавшая электрону собственное вращение с механическим моментом (вектором) s = ½ (в единицах h/2π). Вместе с тем пришлось ввести вместо квантового числа k число l = k—1; таким образом, числом может принимать значения 0, 1, 2.... (n—1).
По схеме Гунда векторы I и s геометрически складываются, причем принимается, что вектор s может иметь только два направления: параллельное или антипараллельное вектору l; в этом случае результирующий вектор при данном значении (рис. 6) может принять одно из двух значений:
![]()
Последний вектор, следовательно, характеризуется третьим (внутренним) квантовым числом j.
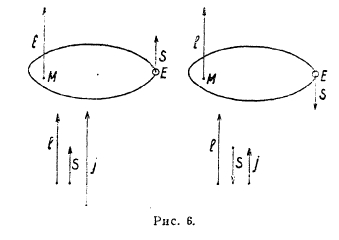
Рис. 6.
Факт расщепления спектральных линий в магнитном поле привел к допущению, по которому плоскости орбит могут иметь различное, но квантованное положение в пространстве, характеризуемое квантовым числом m, причем
![]()
Таким образом, мы получаем четыре квантовых числа, характеризующих орбиту электрона: n, I, j и m. Эти числа приобрели огромное значение для химии после установления следующего принципа Паули: в атоме не может быть двух электронов с одинаковыми четырьмя квантовыми числами.
Так как для n = 1, l = 0, j = ½, m = + ½ или — ½, то электронов с n = 1 может быть только два. Атом водорода обладает одним электроном, атом гелия — двумя; приписав им n = 1, получим, что у водорода m (скажем) равно ½, у гелия один электрон имеет m = ½, другой m = - ½. Этими двумя случаями исчерпываются возможности построения атомов с n = 1, что и отвечает первому периоду системы Менделеева. Два электрона с n = 1 образуют так называемую K-оболочку. повторяющуюся в атомах всех других элементов (ср. спектральный анализ, XLI, ч. 4, 75 сл., и электронная теория, LII, 200 сл.).
Элементам второго периода приписываем n = 2; тогда возможны следующие комбинации:
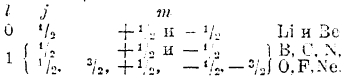
Мы исчерпали возможность построения атомов с n = 2, что и отвечает второму периоду системы Менделеева. Эти электроны образуют L-оболочку, также повторяющуюся в атомах всех остальных элементов.
Из того, что m = j, j — 1,... — (j — 1), —j, видно, что m может иметь максимум 2j + 1 различных значений, откуда на основании принципа Паули следует, что в атоме может быть самое большое 2j+1 электронов, обладающих одинаковыми n, I и j. Эквивалентными электронами называются электроны с одинаковыми n и I; так как j = l ± ½, то очевидно, что число эквивалентных электронов не больше 2(2l+1). А так как далее l = 0, 1, 2,... (n—1), то наибольшее возможное число электронов с данным значением n равно
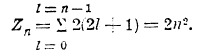
Таким образом, максимальное число электронов при

Однако, из того факта, что в периодической системе в первом периоде 2 элемента, во втором 8, не следует, что в третьем их должно быть 18, а в четвертом 32. Явления здесь более сложны. На самом деле в третьем периоде имеем 8 элементов (от Na до А); главному же квантовому числу n = 3 отвечают следующие возможности:
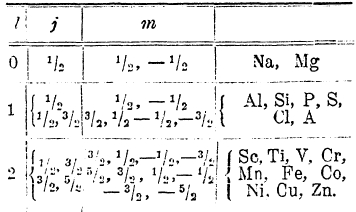
Электроны c n = 3 образуют М-оболочку; очевидно, что квантовому числу n = 3 (оболочке М) отвечает больше возможностей, чем имеется элементы в третьем периоде (8).
Если мы теперь перейдем к четвертому периоду (от K до Kr), то увидим, что в этом периоде 18 элементов, что его элементы нарушают простоту прежних периодов (марганец в группе галоидов, медь в группе щелочных металлов, группа железных металлов и т. п.), что данный период состоит из двух рядов, причем он начинается типичным щелочным металлом (К) и кончается типичным инертным газом (Kr). Бессмертная заслуга Бора состоит в том, что он на основании данных спектроскопии и химии дал объяснение этим фактам. Так как калий является по своим свойствам полным аналогом лития и натрия, то последнему электрону (19-му) в его атоме надо приписать те же свойства, что и последним электронам Li и Na, т. е. 19-му электрону в атоме калия надо приписать числа n = 4, l = 0; другими словами, при переходе от А к K не продолжается замещение новыми электронами еще не заполненных, но возможных орбит с n = 3, а происходит замещение орбит с n = 4:
![]()
В спектроскопии орбиты (уровни, термы) с одинаковыми значениями I обозначают буквами, причем l = 0 отвечает буква s (не смешивать с моментом вращения электрона s!), l = 1 — буква р, l = 2—d, l = 3—f и т. д.; таким образом, 3s означает орбиту n = 3, I = 0, а 5d отвечает n = 5, I = 2.
Все указанные здесь распределения электронов можно сделать более наглядными при помощи следующих схем. Орбиты (или уровни энергии), характеризующиеся одними и теми же значениями квантовых чисел n, I, j, мы обозначаем вертикальной чертой и на ней помещаем столько кружков, сколько электронов, отличающихся друг от друга значениями m, отвечает данным n, I, j. В этом случае распределение электронов в атоме неона представится так:

где наглядно видны незамещенные орбиты 3d, в то время как орбиты 4s уже замещены. Следует отметить, что в настоящее время не делают различий между электронами р, так что вместо двух линий 2р, 3р и т. д. можно ставить одну линию с шестью кружками.
Спектры следующих за кальцием элементов, скандия, титана и т. д., настолько отличны от соответствующих спектров алюминия, кремния и т. д., что их (Sc, Ti,...) нельзя считать прямыми аналогами последних (Аl, Si,...); простейшее объяснение состоит в том, что у Sc новый (21-й) электрон занимает орбиту 3d (n = 3, I = 2), лежащую глубже, нежели орбиты последних электронов калия и кальция. Такое заполнение орбит 3d продолжается у элементы вплоть до Zn, и только начиная с галлия идет дальнейшее заполнение орбит с n = 4, а именно орбит 4р:
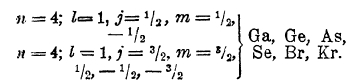
Криптоном заканчивается 4-ый период менделеевской системы; у него вся третья оболочка и все орбиты 4s и 4р уже заполнены; криптон - аналог аргона, и у него результирующие векторы исчезают. Схема криптона имеет вид:
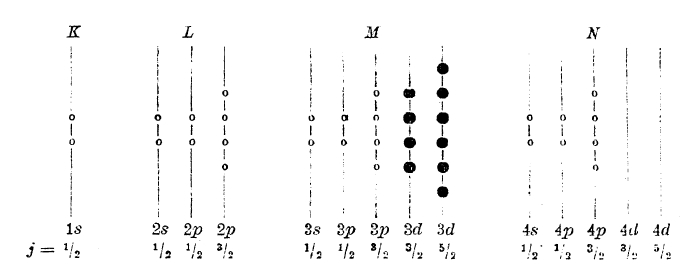
Элементы от Sc до Zn (им отвечают черные кружки в последней схеме) свойствен ряд особенностей: переменная валентность, окрашенность ионов, магнитные свойства и т. д.; эти особенности тесно связаны с тем, что у этих элементы идет достройка глубже лежащей оболочки M. Наши знания в этой области еще недостаточны для полного и детального описания достройки оболочки М, но все же данные спектроскопии и отчасти химии заставляют думать, что заполнение орбит 3р не идет строго последовательно по порядку и что вполне возможны «изомеры» атомов. В нижеследующей таблице показан наиболее вероятный порядок заполнения орбит у элементов 4-го порядка:
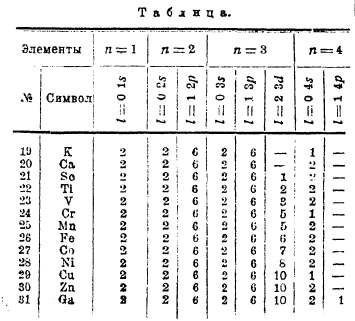
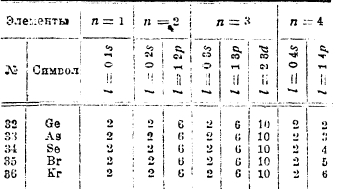
Таким образом, при переходе от V к Сr и от Ni к Сu мы видим и заполнение, и перемещение электронов; очевидно, что возможно и иное расположение электронов, а это и приведет к «изомерам» атомов. Если ограничиться только последними орбитами, то возможны следующие группировки:
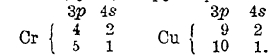
Электроны с n = 4 образуют оболочку N, в ней возможны орбиты 4s, 4р, 4d (I = 2) и 4f (l = 3); в атоме криптона заполнены орбиты 4s и 4р, но при переходе к рубидию, типичному щелочному металлу, мы должны на основании спектроскопических и химических данных заключить, что дальнейшее заполнение оболочки N прекращается, а 37-й электрон у Rb занимает орбиту 5s, 38-й электрон у стронция также занимает орбиту 5s:
![]()
Пятый период менделеевской системы, начинающийся рубидием и кончающийся ксеноном, полностью повторяет историю четвертого периода. А именно: в атомах от иттрия до кадмия новые электроны постепенно занимают глубже лежащие десять орбит 4d, а начиная с индия до ксенона включительно идет замещение орбит 5р.
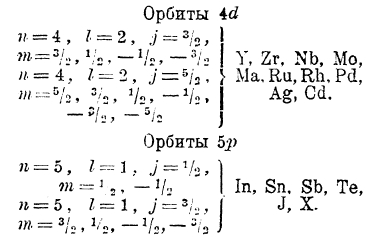
Распределение электронов в атомах этих элементов дано в следующей таблице, в которой опущены электроны в заполненных оболочках:
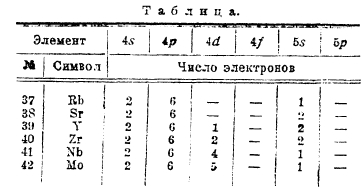
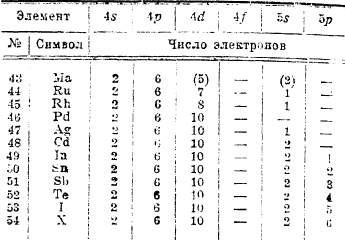
Обращает на себя внимание распределение электронов по орбитам 4d и 5s у элементов с № 40 — 47, особенно у палладия.
Шестой период, начинающийся цезием, значительно сложнее предыдущих двух периодов. 55-й электрон в атоме цезия — щелочного металла — занимает орбиту 6s, 56-й электрон в атоме бария занимает вторую такую же орбиту; это с несомненностью вытекает из спектроскопических данных и вполне соответствует химическим данным. Следовательно, в атомах элементы шестого периода начинают заполняться орбиты с n=6, между тем как незаполненными остались орбиты 4f (n = 4, I = 3) и 5d, 5f и др.
Схема атома бария имеет такой вид (здесь опущены оболочки K, L и M, как простое повторение предыдущих схем):

Особенно важно то, что здесь незаполненными остаются глубоколежащие орбиты 4f. Гениальная догадка Бора состоит в том, что заполнение именно этих орбит 4f создает оригинальную группу элементов, редких земель (см. XXXVI, ч. 1, 251 сл.). элементы редких земель отличаются большим сходством друг с другом, все они главным образом трехвалентны, всегда находятся вместе, нет химических реакций (исключение составляет церий), которые позволили бы их разделять; они дают изоморфные смеси, и единственный метод их разделения и выделения — кропотливейший способ фракционированной кристаллизации. Эта чрезвычайная близость химических свойств в группе элементов редких земель всегда была большой загадкой химии; их нельзя было распределить в системе Менделеева и нельзя было решить вопроса об их числе. Строились даже догадки, что элементы редких земель суть осколки другой системы элементов, остальные члены которой по неизвестным причинам исчезли с поверхности земли.
В каком порядке замещаются орбиты 4f в этой группе, точно неизвестно, так как соответствующие спектры плохо изучены и не расшифрованы. Мы можем только в общих чертах характеризовать их так:
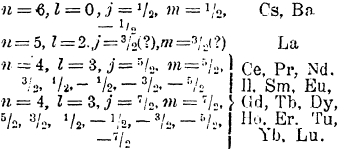
Схематически распределение электронов в атоме лютеция представится так:
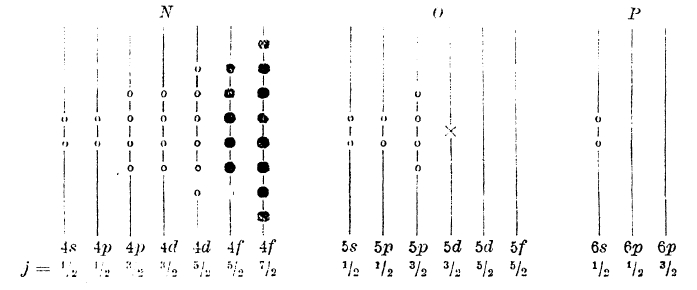
Здесь последний электрон лантана занимает орбиту 5d (Х), последующие электроны — орбиты 4f (•). Очередной элемент гафний получается путем введения электрона на орбиту 6р.
В прежнее время лантан помещали в III группе, а церий и все следующие за ним элементы редких земель (цериды) — в IV группе или в одной клетке, или произвольно расставляли их в ряд без подразделения на группы; не было решительно никаких данных для того, чтобы судить о числе таких элементов. Впервые закон Мозли показал, что от лантана (№ 57) до Та (73) должно быть 16 элементов, что среди уже известных не хватает двух элементов: № 61 и № 72. Поиски № 72 среди элементов редких земель не увенчались успехом, элементы же № 61 был объявлен открытым (иллиний), но, по-видимому, преждевременно. Теория Бора показала, что элементы редких земель в узком смысле слова называются те элементы, следующие за барием, у которых происходит достройка глубоколежащих орбит 4f; следовательно, таких элементов должно быть 14; вместе с тем оказалось, что элемент № 72 не может принадлежать к этой группе, а должен являться аналогом циркония. Действительно, более близкое исследование циркониевых минералов и даже уже выделенных циркониевых солей привело к открытию нового элемента № 72 далеко нередкого и названного гафнием (Hf). По своим свойствам Hf должен занимать место в IV группе, следовательно, лантан и все остальные элементы редких земель (лантаниды) должны занимать одну клетку в III группе (VI периода).
Что же касается элементов от Hf до ртути Hg, то они являются аналогами элементов от Zr до Cd; в их атомах полностью заполнена оболочка N (n= 4), начаты постройкой оболочки О (n=5) и Р (n=6); этим элементам отвечает замещение электронами орбит 5d:
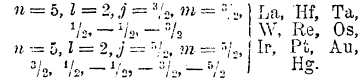
У ртути полностью заполнены оболочки K, L, М и N, из оболочки О замещены орбиты 5s, 5d, и 5р, из оболочки Р - орбиты 6s.
Элементы того же VI периода от Тl до эманации (нитона) аналогичны элементы от In до Х; в их атомах новые электроны замещают орбиты 6р:
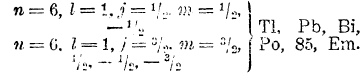
В атоме эманации, заканчивающей собой VI период менделеевской системы, далеко не заполнены все орбиты с n = 6 и с n = 5, тем не менее при переходе к VII периоду мы должны приписать последнему электрону n = 7:
![]()
Элемент №87 неизвестен, но радий — аналог бария — говорит за правильность указанной концепции. В атомах дальнейших элементов можно ожидать замещения орбит 5f и 6d, следовательно, можно ожидать группу элементов, аналогичных лантанидам. Однако, из скудных опытных данных следует, что в атомах актиния, тория, протоактиния и урана начинается достройка шестиквантовой группы:
![]()
следовательно, вплоть до урана отсутствуют аналоги элементов редких земель.
Парные и непарные электроны и валентность. Можно несколько иначе использовать введенные нами квантовые числа, а именно: отказаться от вектора j и взамен его пользоваться моментом вращения электрона s. В этом случае мы принимаем, что магнитное число m может иметь значения, отличающиеся на единицу и лежащие между + l и — l: m = l, l — 1, l — 2, .... —(l— 1), —l. По этой схеме, при n = 1, l = 0, m = 0, а s = или + ½ или — ½. У гелия два электрона в нормальном состоянии атома исчерпывают обе возможности для s и образуют так называемую K-оболочку в атомах. Вращающийся электрон представляет собою магнитик, два электрона с s = ½ и с s = - ½ антипараллельны, действия их элиминируются, их равнодействующая равна нулю. Два электрона с одинаковыми значениями n, I и m, но разнящиеся, значениями s, называются парными, или согласующимися, электронами. Если в двух атомах имеется по электрону, которые вместе могут составить парное сочетание, то такие атомы могут соединиться химически, другими словами: химическая связь обусловливается парным сочетанием согласующихся электронов, находящихся в различных атомах в качестве непарных (Лондон, 1927). Два электрона гелия (в нормальном состоянии) — согласующиеся, отсюда вытекает химическая инертность гелия.
По этой схеме для n = 2 возможны следующие комбинации:
![]() , причем каждая комбинация может быть двоякой с s = + ½ и с s = — ½. Следовательно, с n = 2 возможны 8 электронов, удовлетворяющих принципу Паули, что и отвечает 8 элементам второго периода системы Менделеева.
, причем каждая комбинация может быть двоякой с s = + ½ и с s = — ½. Следовательно, с n = 2 возможны 8 электронов, удовлетворяющих принципу Паули, что и отвечает 8 элементам второго периода системы Менделеева.
У лития 3 электрона, два из них находятся в гелиевой группировке (оболочке К), третий же занимает в нормальном состоянии орбиту 25 (рис. 4). Как видно из рисунка, эта орбита резко отличается от орбит 1s; третий электрон легко отщепляется, образовавшийся ион Li+ имеет гелиевую оболочку. У бериллия два электрона занимают орбиты 2s, у остальных элементов новые электроны занимают орбиты 3р (рис. 4). Две орбиты 2s и 6 орбит 3р образуют у неона замкнутую группировку или оболочку L.
По теории Лондона у фтора из 7 электронов с n = 2 шесть электронов должны быть парными, согласующимися, и только один остается непарным, чем обусловливается одновалентность фтора. У кислорода могут быть два электрона непарными, что и вызывает двухвалентность его.
Для n = 3 возможны следующие комбинации:
 причем каждая комбинация сочетается с s = + ½ и с s = — ½. Следовательно, в третьей оболочке М (n = 3) возможны орбиты: две 3s, шесть Зр и 10—3d (рис. 4). Анализ спектров показывает, что в атоме аргона заняты орбиты 3s и 3p и что результирующие его векторы исчезают.
причем каждая комбинация сочетается с s = + ½ и с s = — ½. Следовательно, в третьей оболочке М (n = 3) возможны орбиты: две 3s, шесть Зр и 10—3d (рис. 4). Анализ спектров показывает, что в атоме аргона заняты орбиты 3s и 3p и что результирующие его векторы исчезают.
С точки зрения теории Лондона в третьем периоде до восьми электронов могут быть непарными. Если у данного атома (например, хлора) все 7 периферических электронов не парны, то валентность его равна 7; если два из них парных, то валентность становится равной 7—2 = 5; если четыре электрона парные, то валентность 7 — 4 = 3 и т. д. У серы шесть периферических электронов, по этой теории валентность серы и может быть равной 6, 4 и 2. Таким путем можно подойти к объяснению, хотя и неполному, валентностей и у остальных элементов.
Мультиплетность и валентность. Следя за характеристиками отдельных электронов атома, можно по мысли Бора объяснить всю периодическую систему элементов Менделеева и устранить те многочисленные недоразумения, которые возникали при чисто химическом подходе к ней. Но как ни велик этот успех, все же он является только первым шагом в теории атома. Основная задача этой теории — объяснение свойств элемента на основании его электронной структуры в целом. К решению этой сложной задачи наука идет двумя путями: опытным изучением и расшифровкой спектров (не только атомов и ионов различной значности, но и молекул) и теоретическим путем (квантовая и волновая механика).
Известно, что большинство спектральных линий в сильных приборах оказывается группами из 2, 3 и более близко расположенных линий; это явление носит название мультиплетности спектров (см. ХLI, ч. 4, 62 сл.). Для ее объяснения надо рассматривать атом в целом, т. е. надо знать результирующие векторы всех внешних электронов, составляющих атом. В простейшем случае щелочных металлов мы знаем, что ионы их имеют электронную группировку инертных газов, т. е., результирующие моменты у них сходят на нет. Следовательно, результирующие моменты I, s, j всего атома щелочного металла совпадают с таковыми последнего (самого внешнего) электрона. Последний электрон в атоме всякого щелочного металла, если атом находится в нормальном состоянии, занимает орбиту ns (n — главное квантовое число, s — означает, что l = 0; если же атом возбужден, то этот электрон может занять любую высшую орбиту; при перескоке с высшей орбиты на одну из низших, атом дает излучение, обнаруживаемое спектральной линией. Каждой орбите отвечает своя энергия атома, свой энергетический уровень; если энергии атома, отвечающие двум орбитам, суть ω1 и ω2, то излучаемая энергия, проявляющаяся в виде спектральной линии, по закону Бора:
![]()
где h — постоянная Планка, v — частота излучения; выражение ω/h называется термом.
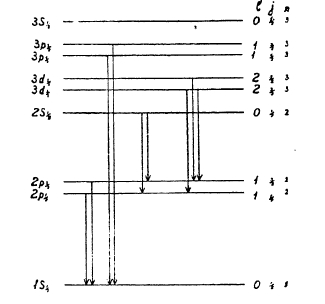
Рис. 7.
Вместо того, чтобы рисовать орбиты, принято условно изображать уровни энергии атома так, как показано на рис. 7, где нижняя линия представляет орбиту с наименьшей энергией (терм на языке спектроскопии) 1s1/2 (n = 1, l = 0, j = ½), числу n=2 отвечают три уровня (терма): 2 s1/2 (n = 2, I = 0, j = ½), 2р1/2 (n = 2, l = 1, j = ½) и 2p3/2 (n = 2, l = 1, j = 3/2) и т. д.
Энергетические уровни, различающиеся только значениями j, близки друг к другу; если электроны перескакивают с уровней n р1/2 3/2 на n s1/2, то получаются спектральные линии весьма близкие, разлагающиеся на компоненты только в сильных приборах; такие линии называются дублетными. Но электрон может перескакивать с высших не только на орбиты ns, но и на любые другие, ниже лежащие, например, с орбит 3d на 2р; орбит 3d две: Зd5/2 3/2 равным образом и орбит 2р две: 2 р3/2 1/2 следовательно, возможны четыре близких спектральных линии: 3
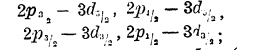
однако, в силу правила отбора (найденного эмпирически и подтвержденного волновой механикой) реальны только те перескоки электронов, у которых Δj=0 или ± 1; следовательно, линия 3d5/2 – 2р ½ не реализуется, и таким образом линия 2р — 3d расщепляется на 3 линии; тем не менее, и эти линии носят название дублетных, так как мультиплетность спектров определяется не числом линий в группе, а тем, что их термы являются двойными, тройными и т. д.
Таким образом, щелочные металлы характеризуются дублетным характером своих спектров. Если самых внешних электронов несколько, то векторы их складываются:
l = ∑li, s = ∑si и j=l+s = геометрической сумме результирующих векторов l и s, причем они складываются так, что возможны следующие значения j целого атома:
![]()
т. е. число значений j равно х = 2s + 1 при l > s.
В случае атома гелия имеем два электрона. Пусть один остается на орбите 1s, другой при возбуждении атома может занять любую орбиту. Так как l1=0,то результирующий вектор атома совпадает с вектором l2. Результирующий же вектор s (s1 = s2 = ½) может принять два значения s = 0 и s = 1. В первом случае, когда s = 0, возможны уровни:
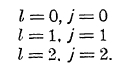
Эти уровни нерасщепленные, и спектр в этом случае состоит из одиночных линий (рис. 8). Во втором случае, когда s = 1, возможны уровни
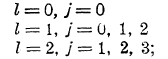
здесь, следовательно, уровни (термы) расщепляются на три близких, уровня (за исключением уровней ns), и спектры состоят из триплетных линий (рис. 8).
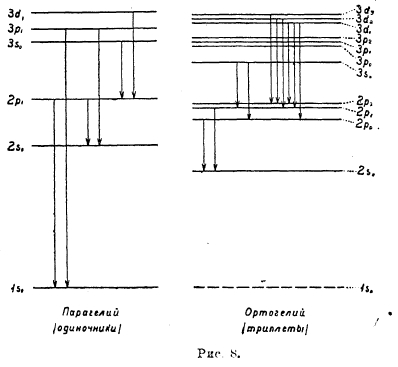
Рис. 8
По квантовой механике переходы между одиночными и триплетными уровнями невозможны, чем объясняется двойственный характер спектра гелия, который раньше приписывали двум модификациям гелия (парагелию и ортогелию).
Понятно, что, если в атоме самых внешних электронов больше двух, то возможна и большая мультиплексность спектра; так, если при наличии нескольких электронов результирующий вектор s = 2, то число значений j, а следовательно и мультиплетность спектра равна х = 2s + 1 = 5.
Исследование спектров различных элементов показало, что спектры эти часто очень сложны и одновременно состоят из линий различной мультиплетности, причем здесь имеется важная связь с положением элементов в периодической системе, а именно в спектрах:

В полном согласии с теорией ионы, несущие один положительный заряд, т. е. потерявшие один электрон, дают спектр, свойственный элементам предыдущей группы; так, Са+ обладает дублетами Sс++ триплетами и т. д.
Замечательные результаты получены для группы элементов редких земель, у которых мультиплетность равна 4 у лантана, правильно возрастает до 11 у гадолиния, а затем падает до 4 у лютеция (кассиопея).
Сопоставляя данные химии и спектроскопии, мы видим тесную связь между спектральной мультиплетностью и химической валентностью у элементов. Очевидно, что электроны, попарно связанные анти параллельными осями вращения, не принимают участия в валентности. Валентные электроны устанавливаются так, что все их векторы вращения параллельны; мы видели, что при этом состояние атома (уровень его энергии) распадается на ряд состояний, очень близких друг к другу, что и определяет мультиплетность спектра х = 2s + 1; если число параллельно направленных вращающихся осей электронов равно n, то n = 2s х = n + 1; но число n определяет валентность элемента, следовательно, валентность на единицу меньше мультиплетности спектра. Возьмем железо; если в нем имеется 6 одинаково направленных электронов, то
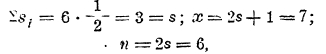
следовательно, в данном случае в спектре имеются септеты, и железо — шестивалентно (железная кислота H2FeO4); если в атоме железа число электронов с анти параллельными осями вращения станет меньше, то и валентность соответственно уменьшится. Отсюда также вытекает правило четности или нечетности валентностей (например, у галоидов 1, 3, 5 и 7, у серы 2, 4, 6 и т. д.). Понятно, что это только первый шаг в выяснении сущности валентности; возникают трудности в объяснении валентностей элементов редких земель (3, реже 2 и 4) при наличии разнообразных мультиплетностей (до 11 у Gd), в объяснении промежуточных валентностей, например, у железа валентности 2, 3, 6 и т. д.
Несомненно, что самые внешние электроны играют важную роль в химических явлениях, но не только ими определяется качественность химического элемента. Валентные электроны обусловливают сходство родственных элементов, качественные же и количественные различия их (например, К и Na) определяются и их ядрами, и всеми остальными внешними электронами; роль последних особенно сказывается у элементов в атомах, в которых имеются недостроенные оболочки.
Ядра атомов, изотопия, дефекты масс. Атомами положительного электричества являются протоны; все протоны атома сосредоточены в ядре его, электроны же частью находятся в ядре, частью вне ядра (внешние электроны). Масса электрона меньше массы атома водорода в 1 844 раза точнее, если атомный вес водорода Н = 1,0078, то вес электрона в атомных единицах 0,000548; в абсолютных единицах масса электрона 0,904·10-27 г (масса 1/16 атома кислорода — 1,6490·10-24). Ядро водорода есть протон, масса протона в атомных единицах принята равной 1,0072, в абсолютных — 1,661·10-24 г.
Основное положение теории атома гласит, что порядковое число элемента есть число положительных зарядов ядра, следовательно, в силу нейтральности атома в целом оно равно числу внешних электронов. Можно было думать, что часть электронов находится в ядре и что масса атома почти определяется массой ядра, содержащего все протоны.
Другими словами, атомный вес элемента-изотопа (округленный) показывает число протонов в ядре (массовое число изотопа).
Атомный вес гелия по точным массспектрографическим данным (Астон) равен 4,00216, т. е. в его ядре 4 протона; порядковое число гелия — два, отсюда следует, что в ядре его атома находятся два электрона, два же других электрона образуют внешнюю электронную сферу. Ядро гелия имеет состав 4h+2ε, где h — протон, ε — электрон; это ядро несет два положительных заряда и носит название α-частицы (см. радиоактивность).
Так как в атомных единицах h = 1,0072, ε = 0,000548, то атомный вес атома гелия = 4h + 2ε + 2ε = 4· 1,0072 + 4·0,000548 = 4,03099, опытный же атомный вес гелия = 4,00216; получается дефект массы = 4,03099 — 4,00216 = 0,02883 атомных единиц или при расчете на грамм-атом гелия 0,02883 г. По принципу относительности Эйнштейна эквивалентность массы и энергии выражается уравнением mс2 = Е, где m — масса в г, с - скорость света 3·1010 см, Е — энергия в эргах.
Мы принимаем, что атом гелия образуется из 4 протонов и 4 электронов; очевидно, что при таком допущении образование грамм-атома гелия сопровождается превращением части массы в энергию, т. е. образование атома гелия из протонов и электронов есть процесс экзотермический. Количество выделяющейся при этом энергии огромно: 0,02883·9·1020 = 2,5947·1019 эрг = 6,2·1011 кал (на каждые 4 г гелия). Непременным следствием потери массы (выделения энергии) является большая устойчивость ядра атома гелия (α-частицы).
Действительный атомный вес α-частицы, очевидно, равен 4,00216 — 2·0,00548 = 4,00106.
Следующий элемент — литий состоит из двух изотопов: Li6 и Li7, их порядковое число Z = 3, следовательно, ядро первого состоит из 6 протонов и 3 электронов, второго из 7 протонов и 4 электронов. Так как α-частицы чрезвычайно устойчивы и при распаде атомов радиоактивных элементов выделяются не протоны, а α-частицы, то надо думать, что протоны и электроны в ядрах атомов организуются в α-частицы; в этом случае ядро Li6 состоит из одной α-частицы, двух свободных протонов и одного свободного электрона, т. е. формула этого ядра: α + 2h + ε, формула ядра Li7: α + 3h + 2ε.
В атоме углерода 12 протонов и 12 электронов, из них 6 в ядре и 6 во внешней сфере. Очевидно, что ядро атома углерода (12h + 6ε) можно считать состоящим из трех α-частиц, т. е. его формула Зα. При образовании атома С из 12h и 12ε получаем атомный вес 1,0072 Х 12 + 0,000548 Х 12 = 12,0930, опытный же вес равен 12,0036; следовательно, получаем дефект массы в 0,0894 атомных единицы, т. е. на г-атом С дефект 8,9 мг. Состав атома С можно считать Зα + 6ε; приняв действительный атомный вес α-частицы 4,00106, получаем атомный вес С: 4,00106 Х 3 + 0,000548 Х 6 = 12,0065, следовательно, даже при образовании атома С из α-частиц и электронов получается дефект массы 12,0065—12,0006 = 0,0029 г, или 2,9 мг.
Дефекты масс растут с атомным весом и доходят до 1,768 г на г-атом у урана, при расчете же на образование из α-частиц дефекты растут до элементы с порядковыми номерами около 50, а у более тяжелых элементов уменьшаются; так, такие дефекты у С—2, 9, у Sn122 — 169, у Ra — 27 мг на г-атом; очевидно, что устойчивость более тяжелых атомов меньше, чем легких (радиоактивность).
Если Z — порядковое число элементов, Nh - число протонов в ядре его (или изотопа), т. е. округленный атомный вес его, то число α-частиц в ядре n = ¼ Nh число всех электронов в атоме Nε = Nh, в ядре N'ε = Nh — Z, число электронов, связанных в α-частицах, отсюда число свободных электронов в ядре пε = Nh—Z—2n. Число свободных протонов в ядре равно остатку от деления Nh на 4, следовательно, равно 1, 2 или 3; в связи с этим все элементы и изотопы могут быть разбиты на 4 группы, атомные веса которых Nh = 4n, 4n + 1, 4n + 2 и 4n + З.
Важнейшие и наиболее распространенные в природе элементы и изотопы принадлежат к классам 4n и 4n + 3. Кроме этого, можно отметить еще следующие эмпирические правила. Гаркинс (ср. электронная теория, LII, 210) установил, что чаще всего встречаются элементы с четными порядковыми числами; он же нашел, что у 97,5% всех атомов в земной коре и у 97% в каменных метеоритах число ядерных электронов четное. Оказывается далее, что элементы с нечетными порядковыми числами или являются чистыми элементы, или имеют два изотопа, атомные веса которых Nh нечетны и отличаются друг от друга на два (например, хлор Z = 17; Сl35 и Сl37; сурьма Z = 51; Sb121 и Sb123; серебро Z = 47; Ag107 и Ag109, и т. д.). Элементы же с четными порядковыми числами имеют много изотопов (олово — 11, ксенон — 9 и т. п.).
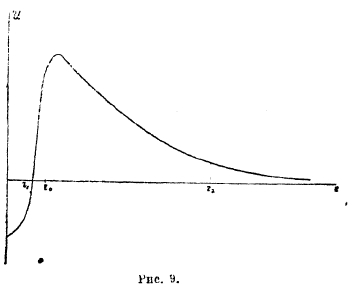
Рис. 9
Для объяснения этих и ряда других правил необходима теория атомного ядра; таковая только начинает строиться (Джерней, Кондон, Гамов). Проблема ядра много сложнее проблемы внешней оболочки атома; на самом деле, радиус ядра атомов r0 = 1,21·10-13 А1·Зсм, где А — атомный вес, следовательно, поперечник ядра атома урана около 15·10-13 см и в нем умещается 238 протонов и 146 электронов. Очевидно, что α-частицы в ядре тесно сжаты, очевидно также, что на таких чрезвычайно близких расстояниях одноименно заряженные частицы не отталкиваются, а притягиваются. Из опытов рассеяния α-частиц при прохождении их через вещества следует, что до расстояний порядка 10-12 см сохраняет силу кулонов закон, т. е. до таких расстояний потенциал ядра равен его заряду, деленному на расстояние. На более близких расстояниях силы отталкивания начинают превращаться в силы притяжения так, что в общем случае потенциальная энергия ядра и α-частицы, находящихся на расстоянии r:
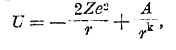
где Z — порядковое число элемента, е — заряд протона, А и k — постоянные. На чрезвычайно близких расстояниях в ядре превалирует второй член в этом выражении энергии; для алюминия критическое расстояние, на котором притяжение начинает превышать отталкивание, равно r0 = 3,44·10-13 см. На рис. 9 показан общая ход потенциальной энергии ядра и α-частицы в зависимости от расстояния; по мере уменьшения r сила отталкивания возрастает, но она возрастает только до некоторого критического расстояния r0, на более же близких расстояниях эти силы круто спадают; очевидно, что внутри ядра энергия α-частиц значительно меньше, чем на расстоянии r0, другими словами: ядро окружено особым потенциальным барьером, который является сильным препятствием как для внедрения, так и для вылета α-частицы из ядра. Так, у алюминия высота барьера около 15·10-6 эргов, энергия α-частиц даже тяжелых радиоэлементов от 6 до 14·10-16 эргов, энергия же своих α-частиц значительно меньше. Тем не менее, из факта радиоактивности и возможности расщепления элементов вытекает, что α-частицы могут перескакивать через такие барьеры. Если полная энергия частицы в ядре Е, а потенциальная энергия барьера U, то всегда Е<U; разность Е—U есть кинетическая энергия; для того, чтобы частица могла вылететь из ядра, ее кинетическая энергия должна была бы быть отрицательной, а, следовательно, скорость мнимой.
Однако, современная волновая механика приводит к возможности таких перескоков, подобно тому как волновая оптика показывает возможность отклонения светового луча от прямолинейного пути. Например, мы знаем, что пучок лучей при падении на границу двух сред под углом полного внутреннего отражения по законам геометрической оптики полностью отражается, между тем как по волновой теории света потоки световой энергии заходят и во вторую среду, хотя в ничтожно малом количестве. Нечто аналогичное происходит и в ядре по волновой механике, по которой всякая движущаяся частица связана с волной (волной материи), распространяющейся со скоростью u, большей скорости света; по уравнению де-Бройля hv=mc2, где h — квант действия, v - частота колебаний, m — масса частицы, с — скорость света. Здесь мы должны различать две скорости: механическую скорость частицы v и скорость волны ее и; эти две скорости связаны друг с другом соотношением uv = с2, следовательно, чем медленнее движется частица, тем больше скорость ее волны; из этих формул следует, что λ=с2/uv или λ=h/mv. Волны материи не являются энергетическими волнами, но они имеют центры энергии, каковыми являются протоны и электроны. Для α-частицы и в ядре атома, движущейся со скоростью, равной 1/20-ой скорости света, длина ее волны около 6·10-13 см., т. е, порядка величины самого ядра.
Волны частиц в ядре падают на потенциальный барьер и отражаются, в результате образуются приближенно стоячие колебания волн, но частью эти волны проникают через барьер, что и обусловливает возможность перескока частицы через барьер. Наглядно этот процесс не может быть описан, как и не может быть объяснен физически смысл мнимой скорости во время перехода через барьер; скорость приобретает реальный характер только после такого перехода. Волновая механика показывает не только возможность такого перескока, но и вычисляет вероятность его. Эта вероятность выражается уравнением р = е7 , где
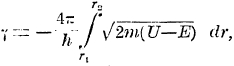
пределы области мнимой скорости, остальные буквы имеют прежние значения; если это выражение помножить еще на частоту обращения α-частицы, т. е. на 1021 (радиус ядра порядка 10-12, скорость движения α-частицы порядка 109 см/сек), то мы получим постоянную радиоактивного распада. То, что γ является степенью е, объясняет, почему при сравнительно небольших отличиях в значениях U и Е периоды полураспада элементы меняются в столь громадных пределах: для RaC' — 10-8 сек, для U — 5 10-9 лет. Результаты подсчетов вполне удовлетворительны, и этот факт подает большие надежды на дальнейшее развитие теории.
Искусственное расщепление атомов. Резерфорду удалось бомбардировкой атомов легких элементов быстрыми α-частицами некоторые из них разбить (см. радиоактивность), причем из разбитого ядра вылетают h лучи, т. е. протоны с большой скоростью. Такое расщепление ядра удается только у элементов более легких, чем аргон и не принадлежащих к классу 4n. Расщепление атомов может быть запечатлено на фотографии; изучение таких фотографий показало, что в каждом случае имеются следы выбитого протона, отскочившего остатка ядра и налетающей α частицы до столкновения, но не после столкновения, откуда следует, что α-частнца застревает в ядре, из которого она выбила протон. Таким образом в результате столкновения происходит выбивание протона (убыль атомного веса на 1) и застревание α-частицы (прирост атомного веса на 4) в ядре, следовательно, из данного элемента получается другой, более тяжелый; так, из азота образуется изотоп кислорода О17, из фтора изотоп неона Ne22. Всегда ли α - частица застревает в ядре - неизвестно. Понятно, что перед теорией ядра здесь встает обратная задача, показать как α-частица переcкакивает через барьер внутрь ядра. Тот факт, что расщеплению подвергаются более легкие элементы, нетрудно понять, так как у них более низкий барьер и следовательно, имеется значительно большая вероятность проскакивания через него. Однако, ряд других моментов ставит теорию ядра в очень трудное положение, из которого пока еще выхода не найдено. Достаточно указать, что в связи с этими задачами опять поднимается вопрос о статистическом смысле закона сохранения элементов.
Следует еще упомянуть, что теория предвидит большую эффективность столкновений протонов (h - частиц) с ядром атомов. Быстро летящий протон значительно легче может проникнуть в ядро и выбить из него α-частицу. Экспериментальная трудность состоит в получении мощных пучков протонов.
Дальнейшие исследования по облучению различных элементов α-лучами привели к поразительным результатам, выдвинув проблему атомного ядра и ядерных реакций на первое место в этом отделе физики. В период 1930—1932 гг. было доказано, что под влиянием бомбардировки α-лучами литий и особенно бериллий испускают потоки особых частиц, обладающих массой, весьма близкой, а может быть и тождественной с массой протона, но не несущей заряда; эти частицы были названы нейтронами (обозначение n10). Отсутствие заряда объясняет огромную проникающую способность этих частиц; они обнаруживаются не непосредственно, а по вторичному явлению: ускорению ядра, с которым столкнулся нейтрон, и последующей ионизации газа.
Вторым крупнейшим открытием, которое было сделано в последние годы при изучении действия космических лучей на вещества с помощью камеры Вильсона, было открытие позитрона —положительного электрона е+ т. е. частицы, равной по массе электрону и несущей тот же заряд, что и обычный электрон, но положительного знака.
Одновременно удалось развить технику получения мощных потоков протонов, ныне обозначаемых через Н11, а также и дейтонов Н12. Обширные исследования по облучению различных элементы α-лучами (они же Не24 - частицы), протонами, дейтонами и нейтронами привели к открытию большого ряда ядерных реакций, из которых в качестве примеров приведем следующие:
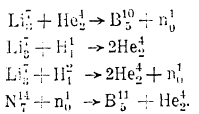
Особенно многочисленны реакции, протекающие между нейтронами и ядрами всех других элементов, так как наличие зарядов у других частиц (Не24, Н11, Н12) ограничивает их возможность проникновения в ядра более тяжелых элементов, обладающие значительными потенциальными барьерами.
При этих опытах И. Кюри и Жолио открыли искусственную радиоактивность, состоящую в том, что элементы продолжают излучать потоки частиц и после прекращения облучения. Рядом остроумных опытов было доказано, что в результате бомбардировки, скажем, алюминия α-лучами сначала образуется изотоп фосфора:
![]()
неустойчивый изотоп Р30 со строго определенным периодом полураспада разлагается на кремний и позитрон:
![]()
Открытие искусственной радиоактивности привело к новому источнику получения позитронов, а открытие нейтрона резко изменило взгляды на строение атомных ядер. Хотя еще далеко не закончены споры о составных частях ядра и о первичных частицах, т. е. о том, является протон нейтроном+позитрон, или нейтрон есть протон+электрон, однако большинство исследователей склоняется к мысли о первичном характере нейтрона. С этой точки зрения в ядрах нет электронов, последние образуются вблизи ядра в его сильном поле. Подобно тому, как квант лучистой энергии (фотон) не входит в состав атома, а рождается, когда энергия атома падает с одного уровня на другой, так и электрон (и позитрон) рождается при переходах ядра из одного состояния энергии в другое. Возможно, что при этом выделяются γ-лучи, которые в силовом поле ядра «материализуются» в электроны.
В ядерных реакциях надо учитывать не только характер ядер и частиц, но и их энергию. Подсчет энергетических балансов в ряде случаев приводил к противоречиям, и, в конце концов, возникло подозрение в правильности определения изотопических весов. Действительно, в 1935 г. Астон печатно сообщил, что его точный масс-спектрограф дает систематическую ошибку и что найденные им изотопические («точные») веса неправильны. В настоящее время (1936) ведется особая работа по вычислению весов изотопов на основании изучения энергий частиц, выделяющихся из ядра при его превращениях. Вообще, надо сказать, что теория ядра только начинает создаваться, и пока еще прочно установленных положений нет.
Ядра атомов в двухатомных молекулах. Молекулам свойственны полосатые спектры (см. XLI, ч. 4, 45), анализ которых в настоящее время привел к ряду весьма важных заключений. Ядра двух атомов в молекуле находятся на определенном расстоянии, и молекула вращается около оси, перпендикулярной к линии, соединяющей ядра, вследствие чего получается момент инерции молекулы. Этот момент инерции определяется разностью длин волн двух соседних линий одной и той же полосы; зная же момент инерции и массы атома, нетрудно вычислить расстояние между ядрами в молекуле; так, ядра атомов водорода в его молекуле находятся на расстоянии 0,75 Å (ангстрем, см. XLI, ч. 4, 41) друг от друга; это расстояние в 1,4 раза больше нормального радиуса водородного атома. В молекуле йода ядра находятся на 2,66 Å. Для ряда случаев установлена периодичность расстояний между ядрами в зависимости от атомного веса элементов. Тот же анализ некоторых ненормальностей спектра привел к открытию изотопов кислорода О17 и О18 (см. выше), а анализ характерных оптических частот молекулы дал доказательства того, что определенное число электронов является общим для обоих ядер.
Но наиболее интересные результаты получены путем рассмотрения явления резонанса с точки зрения волновой механики. Известно, что, если два колебания одинаковой частоты связаны между собой, то возникают так называемые биения, вызывающие смещение чисел колебаний, в результате чего получаются два различных колебания, из которых у одного частота больше, у другого меньше, чем у исходных колебаний. Волновая механика принимает, что такое же явление имеет место, если какие-либо силы действуют между двумя одинаковыми частицами (электронами, протонами или ядрами).
Так, в атоме гелия имеются два внешних одинаковых электрона; в силу резонанса следует ожидать двух систем уровней энергии (термов), а не одной, как у водорода (см. выше о спектрах парагелия и ортогелия). В случае атомов с большим количеством электронов такая связь между ними вызывает распадение системы уровней энергии на несколько частичных систем. Самое интересное это то, что между этими системами могут возникать слабые комбинационные линии только при наличии соответственного вращения электрона. Такие слабые комбинационные линии найдены у гелия, и это служит опытным доказательством собственного вращения электрона.
Явлением резонанса объясняется чередование интенсивности линий в полосатых спектрах двухатомных молекул: в них или выпадает каждая вторая линия, или же слабые и сильные линии правильно чередуются. Это — результат резонанса между одинаковыми атомными ядрами в молекулах элементы (Н2, О2, N2,.. .), причем если ядра не вращаются, то имеет место выпадение линий; если ядра обладают собственным вращением, то наблюдается чередование интенсивностей линий. Оказалось, что ядра гелия и кислорода не вращаются (вокруг собственных осей), ядра же водорода и азота вращаются.
У элементов с атомным весом 4n (Не, O,...) в ядрах имеется четное число протонов и электронов, и в них всегда возможно полное взаимное элиминирование противоположно направленных вращений. У элементов других классов возможны нечетные числа протонов и электронов в ядре (например, у Н, N), и следовательно, такого взаимного уничтожения вращений может и не быть.
Пара- и ортоводород. Если ядра атома водорода (протоны) обладают собственным вращением, то при соединении двух атомов водорода в молекулу (Н2) очевидно возможны два случая: в одном оба протона в молекуле вращаются одинаково, т. е. являются параллельными магнитиками, в другом случае они вращаются в противоположных направлениях и являются анти-параллельными магнитиками. Первый случай отвечает ортоводороду, второй — параводороду. Волновая механика показывает (Деннисон), что обычный водород представляет смесь обоих водородов, причем ортоводорода в три раза больше, чем параводорода, а также, что оба водорода различаются спектрами, теплоемкостями и теплопроводностью и что при понижении температуры ортоводород должен медленно превращаться в параводород.
Эйкену, применившему высокие давления, и Бонгофферу и Гартеку, применившим в качестве катализатора древесный уголь, удалось при 20% абсолютных получить водород, состоящий на 99,7% из параводорода. Оказалось, что последний обладает высшей упругостью пара и низшей точкой плавления, нежели обычный водород.
Орто- и парамодификации молекул свойственны всем тем двухатомным молекулам с одинаковыми ядрами, у которых последние обладают собственным вращением. Спектроскопически найдены две модификации у фтора, азота, хлора и йода. Так как ядро атома кислорода не вращается, то аномалии в его спектре поглощения могут быть объяснены только тем, что наряду с атомами О16 имеются атомы О17 и O18 (см. выше).
Происхождение элементов. Факт распада радиоэлементов с образованием свинца привел к мысли, что все нерадиоактивные элементы суть продукты распада радиоактивных элементы, более тяжелых, чем уран (трансуранов), ныне уже не существующих. Однако, физика, химия и астрономия ставят такие крупные вопросы, что вопрос о трансуранах, родителях нынешних элементов, отпадает. Почему смешанные элементы, независимо от источника их получения, представляют смесь одного и того же состава, почему 95% нашей вселенной построено из очень немногих элементов (водорода, кислорода, кремния и железа), откуда звезды черпают почти бесконечные количества энергии и т. д.?
Конечно, попытки дать ответы на эти вопросы остаются только попытками, но все же и интересными, и ценными. Важнейшие физические данные, на которых базируются эти ответы, относятся к космическим лучам и к теории строения атома. Космические лучи — сильно проникающая радиация — идут к нам из глубин вселенной и состоят из лучей с длинами волн 0,0131, 0,029 и 0,161 Å (Милликен и Камерон). Каковы те процессы, которые могут дать радиации со столь короткими волнами? Первый возможный процесс — взаимное уничтожение протона и электрона, полный их переход в энергию электромагнитных волн. По формуле Эйнштейна-Планка hv = (р + ε)с2 (где h — постоянная Планка, равная 6,55·10-27 эрг. сек., v – число колебаний = c/λ, λ – длина волны, р - масса протона, е —масса электрона, с—скорость света) следует, что длина волны в этом случае 0,013·10-11 см. т. е. совпадает с наиболее короткими космическими лучами. Другие радиации отвечают образованию гелия из протонов и электронов, а по Милликену и атомов кислорода, кремния и, быть может, железа. Следует заметить, что остаются совершенно непонятными те условия, при которых происходит взаимное уничтожение протона и электрона, так как мы знаем, что в ядрах атомов они могут существовать на чрезвычайно близких расстояниях друг от друга.
Равным образом неизвестны еще пути образования, скажем, ядра атома гелия из протонов и электронов или нейтронов. Одновременная встреча четырех протонов и двух электронов или двух протонов и двух нейтронов весьма маловероятна; более вероятно проникновение протонов в готовые ядра элементов; проникшие протоны могут внутри ядра, взяв электроны из внешней оболочки, образовывать α-частицы с испусканием космических лучей; но вопрос о первоначальном механизме образования ядер атомов остается открытым. По-видимому, это — процесс очень сложный, так как постоянный состав смешанных элементов говорит за одновременное образование изотопов по определенному закону; едва ли можно допустить независимое образование изотопов и последующее тщательное их смешение в пределах, скажем, солнечной системы или даже огненно-жидкой земли. Все эти вопросы еще ждут новых материалов и дальнейшей разработки теории.
Литература: Д. И. Менделеев, «Основы химии», изд. 10-е; F. Ephraim, «Anorganische Chemie» ( готовится русский перевод); Л. А. Чугаев, «Периодическая система химических элементов» (1913); А. Eucken, «Lehrbuch der chemischen Physik» (Leipzig, 1930, готовится русский перевод); Н. Moissan, «Einleitung der Elemente» (Berlin, 1904); С. Schmidt, «Das periodische System der chemischen Elemente» (Leipzig, 1917); М. Boll, «Cours de Chimie» (I и II т., Paris, 1927—1928); J. W. Mellor, «Modern Inorganic Chemistry» (London, 1927); Н. Remy, «Lehrbuch der anorganischen Сhemie» (Leipzig, I и II В., 1931); А. Ладенбург, «История развития химии» (Одесса 1917); А. В. Стьюарт, «Новые идеи в физической и неорганической химии» (Лен., 1933); Р. Шварц, «Успехи неорганической химии» (Лен., 1931); Н. Lessheim und R. Samuel, «Die Valenzzahl und ihre Beziehungrn zum Bau der Atome» (Berlin, 1927); G. N. Lewis, «Valence and the structure of Atoms and Molecules» (New-York, 1923); N. V. Sidgwick, «The Elektronic theory of Valency» (Oxford, 1927); А. Зоммерфельд, «Строение атома и спектры» (М., Лен., 1926); Н. Бор, «Три статьи о спектрах и строении атомов» (М., 1923); Ф. В. Астон, «Изотопы» (М., 1923);. Э. Резерфорд, «Бомбардировка атомов и разложение азота»; Г. А. Гамов, «Атомное ядро и радиоактивность» (М., 1930); А. Гаас, «Волны материи и квантовая механика» (М. 1931); А. Гаас, «Квантовая химия» (М., 1931); С. Е. Фриш, «Современная теория спектров» (1931); J. D. Main Smith, «Chemistry and atomic Structure» (London, 1925); Е. N. da С Andrade, «The Structure of the Atom» (London, 1927); «Quanter theorie und Chemie. Leipziger Vorträge» (1928), R. Mecke, «Bandenspektra und ihre Bedeutung für die Chemie» (Berlin, 1929); L. Brillourn, «L atome de Bohr» (Paris, 1931); С. Э. Фриш, «Атомные спектры» 1933); А. К. Вальтер, «Атомное ядро» (1935); Л. В. Мысовский, «Новые идеи в физике атомного ядра» (1935); И. В. Курчатов, «Расщепление атомного ядра» (1935): М. И. Корсунский, «Нейтрон» (1935); Э. П. Жузе, «Тяжелый водород» (1935); М. П. Бронштейн, «Атомы, электроны, ядра» (1935); М. Н. Бронштейн, «Строение вещества» (1935).
А. Раковский.
| Номер тома | 53 |
| Номер (-а) страницы | 413 |
