Этерификация
Этерификация, реакция образования сложных эфиров взаимодействием алкоголей с кислотами как органическими, так и минеральными. Для уксусной кислоты и этилового алкоголя реакция протекает по уравнению:
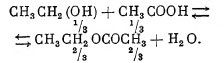
Цифры 1/3 и 2/3 означают, что если взято по 1 молю алкоголя и уксусной кислоты, то система, достигшая равновесия, содержит по 1/3 моля алкоголя + кислоты и по 2/3 моля сложного эфира и воды. Из формулы реакции видно, что реакция не идёт до конца и ограничена пределом. Предел объясняется разложением сложного эфира водой. Кроме существования предела, реакции как прямая, так и обратная, отличаются малой скоростью (медленностью). Скорость пропорциональна молекулярной концентрации:
![]()
Здесь Vn означает скорость прямой реакции, V0 — скорость обратной; К1 и К2 — коэффициенты этих реакций, т. е. скорости их при концентрациях, Сс, Ск, Сэ, Св (концентрация спирта, кислоты, сложного эфира и воды).
В случае равновесия Vn = V0 получаем К1Сс·Ск=К2СЭ·Cв. Отсюда:
![]()
т. к. коэффициенты K1 и K2 при определённых физических условиях постоянны, то их отношение тоже постоянно и обозначается K; тогда имеем:
![]()
Это есть закон действующих масс. Он позволяет выбрать условия для протекания реакции в желаемом направлении и в желаемой степени использования количества взятых продуктов. Так, увеличивая количество кислоты при постоянном количестве спирта, мы увеличиваем количество сложного эфира; то же достигается удалением воды. Наоборот, увеличивая количество воды, вызовем разложение сложного эфира. Это видно из того, что, изменяя числитель дроби в уравнении (1), мы должны изменить и знаменатель, притом так, чтобы величина дроби осталась постоянной.
Если реакция сопровождается тепловым эффектом, то К изменяется с температурой. В случае этерификации тепловой эффект вообще мал, и предел от температуры не зависит; но скорость достижения предела весьма зависит от температуры, увеличиваясь с её повышением. Константа К зависит от температуры. По закону Ле-Шателье-Брауна, если реакция экзотермична (например, Н2 + О = Н2О), то при повышенной температуре равновесие смещается в сторону поглощения тепла разложения воды. Если реакция эндотермична (С2 + Н2 = С2Н2), то при повышении температуры происходит соединение. Скорость и предел этерификации в сильной степени зависят от природы спирта и в малой степени — от природы кислоты. На скорость этерификации влияют катализаторы, особенно кислоты с ионом водорода. Если этерификации подвергаются многоатомные алкоголи, например, глицерин с одноосновной кислотой, то в реакцию вступают последовательно одна за другой по одной молекуле кислоты, в силу того, что многомолекулярные реакции очень мало вероятны.
Реакция этерификации имеет большое значение как в живой природе, так и в технике и лабораторной практике, т. к. сложные эфиры находят разнообразное и важное применение.
Н. Демьянов.
| Номер тома | 54 |
| Номер (-а) страницы | 680 |
