Ферменты
Ферменты (синонимы энзимы, диастазы) представляют собой вещества, которые ускоряют процессы расщепления и превращения химических соединений, входящих в состав растительного и животного организма.
Историческое развитие понятия о ферментах как химических телах. Практическое использование процессов, которые мы теперь называем ферментативными, восходит к самой глубокой древности и во все времена играло большую роль в хозяйстве человечества. Приготовление вина и других спиртных напитков, уксуса, кислого теста, сыра, выделка кож — все эти производства основаны на применении процессов брожения. Термин ферменты, ферментация встречается впервые в сочинениях средних веков и происходит от латинского глагола fervеrе — кипеть, бурлить — и прилагался вначале к процессам, сопровождающимся выделением газа. Начало научному изучению химической стороны процессов брожения было положено в конце ХVIIІ века Лавуазье, который показал, что при сбраживании сахара винными дрожжами он распадается количественно на спирт и углекислоту. С тех пор удалось выяснить те превращения, которые различные химические соединения, входящие в состав растительного и животного организма, претерпевают под действием ферментов, но о внутреннем механизме ферментативных процессов мы знаем еще очень мало. Первая серьезная попытка проникнуть в сущность явлений брожения и выяснить, что такое ферменты, была сделана Либихом в 50-х гг. прошлого века. Основываясь на некоторых наблюдениях и аналогиях, Либих пришел к мысли, что брожение вызывается химическим разложением того материала, который мы считаем ферментом. Это разложение, которое он рассматривает как сотрясение молекул этого материала, передается ферментным веществам, способным к брожению. Разлагающийся белок может привести в гниение прибавленные к нему свежие белковые вещества; разложение пивных дрожжей вызывает сбраживание сахара и т. д. Следующий пример лучше всего выясняет мысль Либиха. Известно, что серебро легко растворяется в азотной кислоте, тогда как платина в ней нерастворима. Но если сплавить серебро с платиной, то сплав растворяется без остатка в азотной кислоте. Получается такая видимость, что серебро, переходя в раствор, как бы вовлекает платину в круг тех изменений, которые оно само претерпевает. Из этого видно, что Либих рассматривает брожение, как химический процесс, вызываемый колебательными движениями молекул ферментов. Последние представляют собой определенные химические тела, их действия лежат в области чисто химических процессов. Мы теперь знаем, что основная мысль Либиха — ферменты, как химические тела — верна, но его объяснение механизма ферментативных процессов лишено основания. Опыт показал, что ферменты не разлагаются в процессе брожения, так как минимальное количество ферментов может вызвать превращение огромного количества субстрата. В спиртовом брожении дрожжи не только не разлагаются, но значительно увеличиваются в весе. Конечно, из этих фактов нельзя еще было сделать вывод, что ферменты не являются химическими телами. Но против Либиха выступил, опираясь на свои ставшие классическими опыты, Пастер, и выдвинутая им виталистическая теория оттеснила на задний план химическую теорию брожения.
Многочисленными и вполне убедительными опытами Пастер показал, что спиртовое и молочнокислое брожение сахара, так же как и другие процессы брожения, вызываются живыми клетками. Без участия живых микроорганизмов не может состояться ни один процесс брожения. Отсюда Пастером был сделан общий вывод, что брожение является результатом жизнедеятельности клетки. Пастер пошел дальше и на примере пивных дрожжей попытался выяснить ближе взаимоотношения между жизнедеятельностью и брожением. Известно, что дрожжи принадлежат к анаэробным, т. е. могущим жить в бескислородной среде, существам. Но так как всякому живому существу кислород необходим, то, по мнению Пастера, дрожжи извлекают необходимый им кислород из сахара, вследствие чего последний распадается на спирт и углекислоту. Свой взгляд он формулировал в знаменитом предложении: la fermentation est le résultat do la vie sans air — брожение есть результат бескислородного существования
Однако, в эпоху, когда Пастер выступил со своей теорией, были уже известны ферментативные процессы, которые не могли уложиться в рамки защищаемых им взглядов. Превращения белковых веществ под действием пепсина, крахмала под действием диастазы, тростникового сахара под действием инвертина, которые с полным основанием рассматривались, как ферментативные процессы, не стояли ни в какой прямой зависимости от жизнедеятельности клеток, так как эти агенты все растворимы в воде и могут проявлять свои специфические действия вне живого организма. Поэтому пришлось провести грань между ферментативными процессами, которые вызываются живыми клетками («организованными» ферментами), и теми процессами, которые вызываются растворимыми («неорганизованными») ферментами, получившими впоследствии название энзим. Между химической теорией Либиха и виталистической теорией Пастера возгорелся спор, в котором победа осталась за последней. Немало содействовало этой победе то, что Либих упорно закрывал глаза на неотразимые факты, установленные Пастером, и даже позволил себе высмеять их в довольно грубом памфлете. Несмотря на то, что с виталистическим объяснением этих фактов не были согласны такие выдающиеся исследователи, как Вертело, Гоппе-Зейлер и Траубе, теория Пастера господствовала в науке вплоть до конца прошлого века. Высказывались взгляды, что и внутри клеток ферментативные процессы обусловливаются действием таких же химических ферментов, как инвертин, пепсин и т. д. Но только в 1897 г. Бухнеру удалось высоким давленном получить из пивных дрожжей сок, который не содержал живых клеток, но энергично сбраживал сахар. В дальнейшем было доказано, что можно умертвить организованные ферменты (дрожжи, молочные бактерии, уксусные и т. д.) действием ацетона или других органических растворителей, не нарушая этим их специфических ферментативных функций. Таким образом, виталистическая теория Пастера, которая рассматривала ферментативные процессы, как неразрывно связанные с жизнью, как результат жизненных функций клетки, оказалась несоответствующей фактам. Если дрожжи и молочнокислые бактерии сбраживают сахар, а уксуснокислые бактерии спирт, то это происходит но потому, что они сами ферменты, а потому что они содержат ферменты, химические тела, вызывающие определенные химические превращения, независимо от того, живет клетка или нет.
Ферменты как катализаторы. Аналогия между действием ферментов и так называемых «контактных» веществ была подмечена давно. Берцелиус впервые объединил обе категории в одно общее понятие «катализа» (см.), который он рассматривал, как проявление свойства некоторых тел «одним своим присутствием пробуждать дремлющие сродства между другими телами». Но взгляды Берцелиуса не давали еще никакого подхода к экспериментальной разработке этого вопроса, и до начала текущего века наши знания о катализе и механизме действия ферментов были весьма скудны. Только в 1902 г. Оствальд дал впервые строго научное определение катализа, которое указало новые пути к экспериментальному исследованию этой важной области. По Остватьду катализ есть изменение скорости самопроизвольно протекающей реакции под влиянием посторонних химических веществ, которые не входят в состав окончательных продуктов реакции. В лаборатории Оствальда вопрос о катализе был подвергнут систематическому исследованию с точки зрения кинетики реакции, и наиболее талантливому из его учеников. Бредигу, удалось доказать, что между чисто химическими катализаторами («неорганическими ферментами») и настоящими ферментами нет никакой принципиальной разницы. По этой причине общепринятое теперь определение ферментов гласит: фермент есть каталитически действующее химическое вещество, вырабатываемое живой клеткой.
Из определения катализа вытекает, что ферменты, как и прочие катализаторы, остаются неизменными по окончании реакций, протекающих под их влиянием. Другими словами, данное количество ферментов может превратить неограниченное количество субстрата, на который он действует. Одна весовая часть фермента сычуга, например, может створожить 30 миллионов частей казеина молока; одна весовая часть фермента инвертазы может расщепить 200 000 частей тростникового сахара, и т. д. В теории предпосылка эта верна, но на практике действие ферментов ограничено, потому что, будучи веществами сравнительно нестойкими, ферменты легко разрушаются под влиянием различных побочных реакций.
Ферменты, как и другие катализаторы, могут ускорять совершающиеся уже реакции, но не в состоянии вызвать реакции, которые без их содействия протекали бы качественно иначе или даже вообще не совершались бы. Другими словами, они ускоряют достижение равновесия в реагирующей системе, но не в состоянии изменить положения этого равновесия. В случае обратимых реакций, т. о., когда конечные продукты одной реакции являются исходным пунктом для противоположной, достигается одно и то же положение равновесия независимо от того, идет ли реакция в одном направлении или в обратном. Например, если смешать уксусный эфир с водой, то по прошествии некоторого времени в смеси получатся определенные количества уксусного эфира, спирта, уксусной кислоты и воды. Но те же количественные взаимоотношения получатся, если смешать спирт, уксусную кислоту и воду. В первом случае идет разложение эфира на спирт и кислоту, во втором образование эфира из спирта и кислоты. В такого рода обратимых реакциях ферменты должны одинаково ускорять как процесс разложения, так и процесс образования. На этом основано синтетическое действие ферментов, предусмотренное теорией и подтвержденное опытом. По сравнению с неорганическими катализаторами ферменты отличаются большой специфичностью. Раствор кислот, правильнее, содержащиеся в них ионы водорода действуют как катализаторы и одинаково расщепляют белки, жиры и углеводы (сахаристые вещества). Иначе обстоит дело с ферментами. Те из них, которые ускоряют разложение белков, никакого действия не оказывают на углеводы и жиры, и наоборот. Специфичность идет еще дальше, так как в пределах одной группы фермент, действующий на крахмал, не оказывает влияния на мальтозу, фермент, действующий на молочный сахар, не оказывает влияния на тростниковый сахар и т. д. Это явление специфичности можно объяснить только предположением, что между ферментом и субстратом, на который он действует, существует определенное химическое сродство. Это значит, что ферментативное действие может проявиться лишь в том случае, если фермент и субстрат вступают между собой в химическое соединение, которое затем распадается на фермент и измененный субстрат. Такой взгляд на характер ферментативных реакций находит свое подтверждение в изученной до сих пор кинетике их.
Физические и химические свойства ферментов — ферменты представляют собой типичные коллоиды (см. белки, VII, 330). Они обладают значительным сродством к воде и образуют с нею так называется соленые растворы, в которых под ультрамикроскопом видны взвешенные частицы. Осмотическое давление ферментных растворов очень слабо, и вследствие этого они слабо или вовсе не диализируют сквозь полупроницаемые перепонки. Важнейшая особенность ферментов, обусловливаемая их коллоидальным состоянием, — это их способность адсорбировать на своих коллоидальных частицах вещества, находящиеся в растворах. Адсорбцией анионов они могут заряжаться отрицательно, адсорбцией катионов — положительно по отношению к растворителю. Упомянутая выше способность ферментов образовать промежуточные соединения с субстратами в первую очередь рассматривается, как явление адсорбции. С другой стороны ферментов, в свою очередь могут адсорбироваться на поверхности твердых тел. Этим свойством пользуются для выделения ферментов из растворов. Как и другие коллоиды, ферменты выпадают из их водных растворов при действии органических растворителей, которые, как спирт, ацетон и др., сами растворимы в воде. Выпадение происходит здесь вследствие более или менее полного отнятия воды от коллоидальных частиц. По этой же причине ферменты выпадают при действии концентрированных растворов солей, жадных к воде.
Характерным для ферментов являются их термолабильность, т. е. их свойство терять свою активность при нагревании их растворов до 60—100°, и это считается единственной особенностью, которой ферменты отличаются от неорганических катализаторов. Но этот критерий имеет только относительную ценность, так как термолабильность ферментов зависит от целого ряда факторов, которые не могут быть причислены к основным свойствам ферментов. В сухом виде ферменты переносят температуру в 120—150° без значительного уменьшения их активности.
Химическая природа ферментов остается до сих пор еще совершенно неизвестной. Несмотря на то, что применением усовершенствованных методов очистки удалось повысить активность, следовательно и чистоту, ферментных препаратов в сотни и далее тысячи раз, до сих пор не установлено, к какой категории химических соединений принадлежат ферменты. Принято считать, что они являются отдаленными производными белковых веществ. Они всегда содержат азот, но не дают типичных реакций на белковые вещества.
Распространение и выделение ферментов — ферменты образуются только в теле живых клеток. Их деятельность необходима для жизненного процесса, но она проявляется ими и вне живой клетки. Большинство ферментов встречаются уже в простейших одноклеточных организмах. Между ферментами низших и высших организмов до сих пор не установлено какой либо существенной разницы. Из ферментов одни прочно связаны с анатомическими элементами клетки, другие, наоборот, легко извлекаются водой из раздробленного материала. Но и тут между теми и другими принципиальной разницы нет.
Для извлечения ферментов второго рода, раздробленный материал обрабатывают водой, раствор фильтруют и осаждают коллоидальные вещества его спиртом, ацетоном или солями, обладающими большим сродством к воде (сернокислый аммоний, сернокислый магний и т. д.). Полученный осадок вновь растворяют в воде, осаждают спиртом и повторяют эту операцию несколько раз. Для дальнейшей очистки ферментов растворы их подвергают диализу или ультрафильтрованию через фильтры из коллодиона, которые не пропускают коллоидальных частиц. В последние годы стали применять с большим успехом для очистки ферментов адсорбцию их на каолине, окиси алюминия, окиси железа и т. д. и последующую элюцию (вымывание) водою в присутствии аммиака или другого вещества. Благодаря этому методу удалось повысить активность, а следовательно и чистоту, ферментов в сотни и тысячи раз.
Для извлечения ферментов первого рода необходимо полностью разрушить анатомическую структуру клеток, что достигается механическими или химическими средствами. В дальнейшем поступают, как указано выше.
Физиологическое значение и классификация ферментов. Для выполнения своих жизненных функций — передвижения соков, роста, размножения и т. д. — организм должен непрерывно расходовать энергию. Эту необходимую ему энергию он черпает из органических веществ, служащих ему пищей, — углеводов, белков и жиров, — превращая содержащуюся в них потенциальную энергию в кинетическую. Единственным способом использовать всю потенциальную энергию органических веществ является их полное сожжение, т. е. их соединение с кислородом. Операция эта осуществляется легко при быстром сгорании, когда под влиянием развивающейся высокой температуры органические вещества разлагаются, образуя легкогорючие химические соединения. Так как жизнь несовместима с высокой температурой, то вполне очевидно, что организм может использовать потенциальную энергию пищевых веществ только окисляя их при температурах, не превышающих 40°С, посредством кислорода воздуха. Но для этого пищевые вещества должны быть предварительно подготовлены в двояком направлении. Во-первых, все окислительные процессы происходят в тканях. Поэтому первоначальные пищевые вещества — крахмал, белки, жиры — должны быть приведены путем химических превращений в такое состояние, при котором они легко проходят через полупроницаемые оболочки. А это достигается постепенным упрощением состава их, постепенным уменьшением их химических молекул (см. пищеварение). Во-вторых, доставленные в ткани сравнительно упрощенные органические вещества должны в них подвергнуться дальнейшей подготовке к окончательному окислению кислородом при нормальной температуре организма. Вот эта работа подготовки органических веществ к окончательному окислению, работа, которая при быстром сгорании осуществляется высокой температурой, при медленном сгорании их в организме живых существ производится ферментами. Ферменты понижают температуру окислительных процессов, необходимых для полного энергетического использования органических пищевых веществ.
Из вышесказанного вытекает естественная классификация ферментов по признаку их физиологических функций, тех основных химических реакций, на которых зиждется их действие и которые в свою очередь обусловливаются химической структурой пищевых веществ.
По своему элементарному составу жиры и углеводы являются соединениями углерода, водорода и кислорода; в белковых веществах к этим элементам прибавляется еще азот. Эти элементы образуют определенные, основные группировки (Bausteine), характерные для каждой категории веществ. Жиры построены из жирных кислот и глицерина; углеводы — из шестиатомных сахаров (гексоз), представителем которых является виноградный сахар, или глюкоза; белковые вещества — из аминокислот. Несмотря на различие их основных группировок, общим для всех трех категорий является то, что их группировки соединяются между собой в сложные молекулы путем выделения воды. Если для простоты мы возьмем представителем эфиров, к которым относятся жиры, уксусно-этиловый эфир, то мы будем иметь:
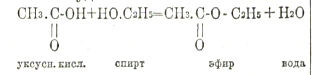
Точно так же 2 молекулы глюкозы, теряя 1 молекулу воды, образуют дисахарид; 2 молекулы аминокислот, теряя 1 молекулу воды, образуют дипептид и т. д. Обратно: расщепление эфиров на кислоты и спирты, расщепленные полисахаридов на простейшие сахара С6Н12О6, расщепление полипептидов на аминокислоты может произойти лишь путем присоединения элементов воды. Например:
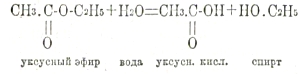
Вода разрывает тут связь между двумя атомными группировками, соединенными, между собой атомом кислорода. Этот процесс обозначается названием гидролиза. Ферменты, ускоряющие гидролиз органических веществ, к какой бы категории последние не принадлежали, образуют один большой отдел гидролиза. После расщепления пищевых веществ на простейшие группировки они поступают в ткани и в них подлежат окончательному разрушению путем окисления, причем их углерод превращается в углекислоту, водород в воду, а азот в мочевину. Этот распад вызывается разрывом связей, соединяющих атомы углерода в отдельные группировки. Ферменты, ускоряющие разрыв связей между атомами углерода, ускоряющие десмолиз, получили название десмолаз и образуют 2-ой большой отдел ферментов.
Классификация главнейших ферментов
Отдел А. — Гидролазы.
Ферменты, расщепляющие путем присоединения элементов воды (гидролиза) жиры, углеводы и белки на простые атомные группировки (Bausteinc) без разрыва связей между атомами углерода, входящими в состав молекулы.
Подотдел I. — Липазы или эстеразы. Ферменты, расщепляющие натуральные жиры и другие простые эфиры.
Подотдел ІІ. — Карбогидразы или сахарозы. Ферменты, расщепляющие углеводы на простые сахара С6Н12О6.
1. Амилаза — превращает крахмал в мальтозу, гликоген (животный крахмал) в глюкозу.
2. Мальтаза — превращает мальтозу или солодовый сахар в 2 молекулы глюкозы.
3. Инвертаза — превращает тростниковый сахар в 1 молекулу глюкозы и 1 молекулу фруктового сахара (левулозы).
4. Лактаза — превращает молочный сахар в 1 молекулу глюкозы и 1 молекулу галактозы.
Подотдел III. — Протеазы. Ферменты, расщепляющие белковые вещества до аминокислот.
1. Пепсиназы, в присутствии кислот превращают природные белковые вещества в альбумозы и пептоны.
2. Триптазы — расщепляют природные белки на полипептиды.
3. Эрептазы — расщепляют полипептиды на аминокислоты.
Отдел Б. — Десмолазы.
Эти ферменты, постепенно разрывая связи между атомами углерода, приводят основные группировки пищевых веществ к их конечным продуктам распада и тем освобождают весь запас энергии, который в них содержится. Они являются ферментами обмена веществ в более тесном смысле.
Подотдел I. — Зимазы. Расщепляют глюкозу и другие гексозы. Реакции окисления и восстановления, вызывающие расщепления, происходят за счет элементов воды.
1. Невыделенный фермент, превращающий глюкозу в пировиноградную кислоту.
2. Фермент, превращающий глюкозу в молочную кислоту.
3. Карбоксилаза, расщепляющая пировиноградную кислоту на уксусный альдегид и углекислоту.
4. Альдегидраза, превращающая 2 молекулы альдегида в 1 молекулу кислоты и 1 молекулу спирта.
Подотдел II. — Оксидазы. Окисляют посредством кислорода воздуха или перекисей промежуточные продукты, образующиеся при ферментативном распаде основных атомных группировок.
Таким образом, схематически процесс обмена веществ в организме представляется в следующем виде.
Высокомолекулярные пищевые вещества действием гидролаз расщепляются на сравнительно простые, легко проходящие через полупроницаемые перепонки атомные группировки (Bausteinе). Последние в тканях действием десмолаз частью без участил кислорода (анаэробно), частью с участием кислорода (аэробно) приводятся через последовательный ряд промежуточных продуктов к конечному результату обмена веществ — к углекислоте, воде и мочевине.
А. Бах.
Литература. С. Oppenheimer, «Die Fermentе mid ihro Wirkungen» 5 Aufl. 926. Н. Euler, «Chemie der Enzyme», 1926. W. М. Вayliss, «The nature of the enzymaction», 1922 (русский перевод печ.) И. А. Смородинцев. «Учение о ферментах».
| Номер тома | 43 |
| Номер (-а) страницы | 224 |
