Фотохимия
Фотохимия, отдел науки, занимающийся вопросом о химических превращениях в материальных телах, происходящих под влиянием воздействия лучистой энергии, в частности света.
Если перед нами вещество, имеющее в своем спектре поглощения одну простую полосу, то при воздействии света распадение вещества происходит пропорционально количеству поглощенной энергии и независимо от длины волны луча. При сложных полосах получается наложение эффектов в разных частях спектра, и общий результат воздействия лучистой энергии может быть очень сложным. По механизму своему фотохимические реакции нужно отнести к реакциям вторичным: первичную стадию процесса составляет вылетание из нейтральной молекулы электрона и образование способного к реакции иона. В случае газов при реакции электрон может и не отделяться, а переходит на устойчивые орбиты, лежащие более далеко от атомного ядра, чем первоначальная орбита (см. элементы). Новая образовавшаяся молекула будет иметь большую энергию, чем первоначальная. Образовавшиеся под влиянием света ионы или молекулы с большой энергией вступают в ряд дальнейших реакций, и простейшим по механизму случаем реакции является такой случай, когда существует только одна реакция ионов, образовавшихся под влиянием света, с окружающими телами. Этот случай представляет простую необратимую фотохимическую реакцию. Возможны, однако, и другие, более сложные случаи: возможно, например, образование из продуктов реакции в темноте новых тел, причем мы, таким образом, получаем ряд новых веществ, и возможно, что продукты этих вторичных реакций будут тождественны с начальными исходными продуктами реакции фотохимической. В этом случае после воздействия света комбинация веществ, оставленная в темноте, снова возвращается к своему первоначальному состоянию, и повторением освещения и затемнения можно реакцию вести в прямом и обратном направлении любое число раз. Реакция в этом случае носит название обратимой. Возможны такие случаи обратимых реакций, между прочим, тогда, когда и прямая и обратная реакция являются фотохимически чувствительными под влиянием лучей разной длины волн. Примером такой реакции является образование озона О3 из кислорода О2 под действием ультрафиолетовых лучей по уравнению: ЗО2 = 2О3. Однако, другая группа ультрафиолетовых лучей другой длины волны переводит озон обратно в кислород, так что, освещая обеими группами лучей кислород, мы получим озон в количестве, зависящем от относительной яркости тех и других лучей. В 1912 г. Эйнштейн указал на интересную связь между фотохимическим процессом и теорией атомов энергии (квантов). По Эйнштейну, один квант энергии должен, поглощаясь одной молекулой светочувствительного тела, ее разлагать. Однако, сравнение хорошо изученных до 1925 г. фотохимических реакций показывает, что только единичные реакции повинуются этому основному закону. Так как главным при фотохимической реакции является образование молекул, обладающих большой энергией, то возможны такие случаи, когда само реагирующее вещество нечувствительно к свету, будучи для данной радиации лучей прозрачно, но когда подмесь светочувствительного тела может вызвать, тем не менее, реакцию. Так, например, подмесь хлора, поглощающего лучи видимого спектра, вызывает, благодаря выделению электронов из хлора и их осаждению на молекулах нейтральных газов, такие реакции, которые при других условиях не текут. При этом сам хлор в реакции не участвует. Такие тела, возбуждающие, благодаря поглощению света, реакцию и сами в ней не участвующие, носят название сенсибилизаторов реакции. Может случиться, что сенсибилизатор, будучи сложным телом, распадается на свету, давая ионы и электроны, которые в свою очередь, осаждаясь на нейтральных молекулах, делают их способными к реакциям. К такого рода процессам нужно отнести реакцию сенсибилизации фотографических пластинок.
Являясь реакциями особого типа, сопровождающимися выделением потока электронов из нейтральных молекул, фотохимические процессы представляют и другие особенности. Так, нагревание, ускоряющее вообще все химические реакции, оказывает весьма малое влияние на реакции фотохимические, которые в этом отношении напоминают радиоактивные процессы и химические процессы при высоких температурах. Нужно отметить, что многие физиологические процессы, например зрение, усвоение углерода, связаны с фотохимическими процессами.
Для ознакомления с основами фотохимии можно рекомендовать: I. Plotnikow, «Photoсhemie»; F. Weigert, «Chemische Wirkungen des Lichtes»; статья R. Luther’а, «Photoсhemie» в «Kultur der Gegenwart»; Scheppard, «Photochemistry»; П. Лазарев, «Фотохимия» в сборнике «Новые идеи в физике» (вып. 4); П. Лазарев, «Ионная теория возбуждения», 1923. Для ознакомления с приложениями фотохимии к зрению см. П. Лазарев, «Исследования по ионной теории возбуждения», 1916; П. Лазарев, «Основы учения о химическом действии света», 3 части, 1919—20. П. Лазарев.
Изучение действия света на химические процессы началось давно. Дрепер (1843) изучал действие света на реакцию образования хлористого водорода (Н2 + Сl2 = 2НСl), причем указал, что действуют только те лучи, которые поглощаются. Он сделал также интересное наблюдение, что хлор, который подвергся действию света (инсоляции), обладает иными свойствами, чем не инсолированный, и соединяется с водородом c гораздо большей скоростью (под действием света), чем хлор, предварительно неосвещенный, при тех же условиях. Дрепер предположил, что хлор переходит в аллотропическое видоизменение. Это мнение было опровергнуто Бунзеном и Роско (1857), которые c большой тщательностью исследовали эту реакцию. С помощью устроенного ими прибора они измерили скорость реакции при различных условиях и нашли, что присутствие следов паров воды ее ускоряет. Впоследствии Бекер показал, что совершенно сухие хлор и водород не действуют друг на друга под влиянием света. Бунзен и Роско открыли существование так называемого «индукционного периода»: чувствительность к действию света газовой смеси медленно возрастает со временем и достигает максимума после 3—6 дней. В присутствии небольшого количества кислорода максимум индукции очень сильно падает, так что в присутствии 1,3% кислорода реакция идет с постоянной, но очень малой скоростью.
Лемуань (1877) показал, что йодистый водород при действии света разлагается: 2HJ = Н2 + J2, причем степень разложения достигает 80% в течение одного месяца. Разложение происходит в синем сосуде быстрее, чем в красном. Шастэнь (Chastaign, 1878) нашел, что под действием красных лучей неорганические соединения окисляются и под действием фиолетовых восстановляются, органические же соединения всегда окисляются. На этом основано устройство актинометра (см. I, 632). Свет ускоряет реакцию охлорения. При действии прямого солнечного света на смесь 1 объема хлора и ½ объема метана (СН4) происходит взрыв, на рассеянном же свету происходит реакция замещения, и получаются: СН3Сl, СН2Сl2 и т. д. Свет изменяет направление реакций: так, при действии хлора на толуол (С6Н5СН3) на свету получается хлористый бензил (С6Н5СН2Сl), а в темноте хлоротолуол (С6Н4СlСН3); при действии хлора на бензол (С6Н6) при действии света получается продукт присоединения: С6Н6Сl6, а в темноте — продукты замещения. Под влиянием света происходит переход одной аллотропической формы в другую, а также изомеризация и полимеризация соединений, причем большей частью получаются более стойкие изомерные формы. Приведем несколько примеров: белый фосфор переходит в красный, малеиновая кислота — в фумаровую, антрацен переходит в диантрацен — 2С14Н10 = С28Н20. Последняя реакция, изученная Лютером и Вейгертом, является обратимой: на свету антрацен в растворе переходит в диантрацен, в темноте же диантрацен распадается на антрацен. От действия света ацетилен превращается в бензол, а из олефинов получаются тетраметиленовые углеводороды. Итальянский химик Чамичан (1912) произвел очень много интересных наблюдений, из коих приведем только следующие: под влиянием света происходит одновременно процесс окисления и восстановления, причем из более простых молекул получаются сложные. Примеры: при действии света на смесь ацетона и метильного спирта получается изобутиленгликоль: СН3СОСН3 + СН3ОН = (СН3)2С(ОН).СН3ОН. Если в этой смеси заменим метальный спирт этильным, то получим триметиленгликоль: СН3СОСН3 + С3Н5(ОН) = (СН3)3С(ОН).СН(ОН).СН3.
Еще более сложные продукты получаются при конденсации под действием света из кетонов, причем одновременно с соответственным алкоголем получаются дикетоны — тела, способные к самым разнообразным реакциям. Например, метилэтилкетон переходит во вторичный бутиловый алкоголь и парадикетон:
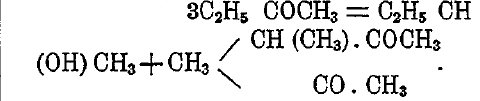
Хинон С6Н4О2 при действии света окисляет спирты как одноатомные, так и многоатомные; таким образом получается из винного спирта альдегид, из глицерина — глицероза, из маннита — манноза; здесь нужно отметить то, что без содействия света для этих реакций окисления нужно прибегать к энергичным окислителям, при содействии же света окисление совершается на счет такого слабого окислителя, как хинон.
При действии солнечного света на водный раствор цианистоводородной кислоты (HCN) и ацетона (СН3 СО СН3) был получен ряд продуктов, из коих главными являются: окси-изо-маеляная кислота (СН3)2 С(ОН)СО2Н и ее амид (СН3)2 С(ОН)CON Н2 ацетонил мочевина С5Н8О2N2 и амино-изо-масляная кислота (СН3)2 С (NH2). СО2Н.
О разложении галоидных солей серебра и т. п. см. фотография. Следует отметить, что свет не всегда действует в том же направлении, как и тепло.
Ив. Каблуков.
| Номер тома | 44 |
| Номер (-а) страницы | 414 |
