Гальванизм
Гальванизм, отдел учения об электричестве.
Под этим несколько неопределенным термином понимают то, вообще, изложение способов возбуждения электрического тока, его свойств и действий, то лишь изложение того процесса получения тока, который ведет начало от Гальвани и Вольта и сводится к употреблению т. н. гальванических элементов. Настоящая статья примыкает скорее ко второму, более узкому пониманию термина гальванизм.
История гальванизма. Итальянский анатом Кальдани в 1756 г. заметил, что тело недавно убитой лягушки содрогается под действием электрического удара. В 1780 (по другим источникам в 1786 или 1789) году болонский медик Гальвани случайно заметил необыкновенную чувствительность известным образом препарированной лягушки к слабым электрическим разрядам. Лягушечий препарат Гальвани состоял из задних лапок, с которых снята кожа, и которые двумя нервами соединяются с несколькими позвонками (рис. 1).
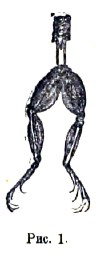
Такой препарат лежал на столе, на котором находилась электростатическая машина. Когда один из помощников Гальвани случайно слегка прикоснулся острием скальпеля к нервам лягушки, то все мускулы лапок обнаружили судорожные сокращения; другой же заметил, что это происходило тогда, когда из кондуктора машины извлекалась искра. В этом явлении имел место так называемый возвратный удар, нерв вместе с проводником, соединяющим его с землей (лезвие скальпеля, тело экспериментатора), электризуется чрез влияние кондуктора машины. Как скоро из кондуктора извлекается искра и он разряжается, разложенное электричество препарата снова приходит в нейтральное состояние, действуя на нерв, как всякий электрический разряд. Заинтересованный новым наблюдением, Гальвани стал производить дальнейшие опыты. Он захотел выяснить, произведет ли атмосферное электричество на лягушечий препарат такое же действие, как электричество машины. С этой целью он вешал на открытом воздухе препарированную лягушку во время грозы, соединяя ее металлической проволокой с землей: всякий раз, как сверкала молния, мускулы сильно сокращались. Наконец, Гальвани заметил, что иногда те же характерные содрогания обнаруживаются и в ясную погоду у лягушечьих лапок, заготовленных для опытов и привешенных к железной решетке балкона с помощью латунных крючков, воткнутых в позвоночный столб. Сначала он думал, что и здесь причиной являются изменения в электрическом состоянии атмосферы; но заметив, что сокращения появляются всякий раз, как устанавливается более тесное соприкосновение между крючком и решеткой, он стал повторять тот же опыт в закрытом помещении, причем клал лягушку на железную пластинку и прижимал к этой пластинке крючок, продетый через позвоночник. К его чрезвычайному удивлению, явление судорожного сокращения мускулов при этом каждый раз повторялось. Он стал повторять этот опыт, разнообразя взятые металлы: результат был тот же самый; только при употреблении одних металлов сокращения совершались сильнее, чем при употреблении других. При замене же металла каким-нибудь изолятором сокращения не получалось. Далее оказалось, что два металла, соприкасающиеся с лягушечьим препаратом, не должны необходимо быть в соприкосновении друг с другом; достаточно включить между ними какой-нибудь проводник, например, человека или «цепь» из нескольких людей, взявшихся за руки. В этом состоят главные факты, опубликованные Гальвани в 1791 году. Мы видим, что он первый констатировал два факта первостепенной важности: 1) что комбинация из двух металлов и лягушечьего препарата дает электрическое действие; 2) что сила этого действия зависит от рода взятых металлов. Совершенно очевидно, что вышеупомянутая комбинация составляет своеобразный гальванический элемент; поэтому является вполне законным, что область физики, в которой рассматривается действие элементов, носит имя, напоминающее о Гальвани. Что касается упомянутого в начале статьи опыта Кальдани, то он сам по себе имеет малое значение для физики; в руках Гальвани это явление сыграло роль лишь постольку, поскольку нерв лягушки являлся здесь чувствительным гальваноскопом.
Итак опытам Гальвани принадлежит основное значение в истории науки, но этого нельзя сказать про данное им теоретическое объяснение этих опытов. Гальвани полагал, что источником электричества в его опыте с животным препаратом и двумя металлами является животный препарат, и что таким образом установлено существование особого животного электричества; нерв и мускул лягушки он уподоблял двум обкладкам Лейденской банки, а металлам приписывал лишь несущественную роль разрядника. Это ошибочное воззрение Гальвани нашло себе критику в работах Вольта, относящихся к 1792-1796 гг. Обратив надлежащее внимание на ту роль, которую в описываемых опытах играет присутствие разнородных металлов, Вольта выставил гипотезу, согласно которой электрическое возбуждение обусловлено здесь не присутствием животного организма (играющего лишь пассивную роль), а соприкосновением разнородных металлов, как между собой, так и с жидкостями тела лягушки. Вольта первый высказал также мысль, что в опыте Гальвани мы имеем длящееся движение электричества (постоянный электрический ток). В дальнейшем Вольта дал чрезвычайно широкое обобщение наблюдения, сделанного Гальвани. Устанавливая разделение проводников электричества на два класса, он отнес к проводникам первого класса все металлы, соединения металлов с кислородом и серой, а также уголь; к проводникам второго класса - различные водные растворы (по современной терминологии - электролиты). Различие между обоими классами характеризуется следующим, установленным Вольта, экспериментальным законом: электрический ток возникает всякий раз, как составляется замкнутая цепь, по крайней мере, из трех проводников, причем по крайней мере один из них должен принадлежать ко второму классу. Таким образом, возможны 3 простейших случая: 1) два различных проводника первого класса соприкасаются с проводником второго класса (частный случай - комбинация Гальвани из двух металлов и лягушки); 2) один проводник первого класса соприкасается с двумя различными проводниками второго класса; 3) соприкасаются три различных проводника второго класса. В каждом из трех перечисленных случаев замкнутой цепи имеются три места соприкосновения разнородных тел, служащие ареной так называемых «электродвижущих сил»; направление и величина этих электродвижущих сил обусловливается природой соприкасающихся тел; от относительной величины и направления их зависит направление движения электричества в цепи.
Вольта открыл также ряд других важных фактов, а именно: вместо двух различных металлов (см. указанный выше случай) можно пользоваться для устройства цепи одним металлом, если только его концы в каком-нибудь отношении физически различны, например, обладают различной степенью твердости, или один окислен более другого (особенно деятельной оказалась комбинация из чистого и окисленного свинца); также вместо двух различных жидкостей можно пользоваться одной в двух различных концентрациях (это - т. н. концентрационный элемент); если цепь состоит из нескольких металлов и нескольких жидкостей, то на силу электрического действия оказывают большое влияние размеры поверхности соприкосновения какого-нибудь металла с жидкостью или двух жидкостей между собой; напротив, величина поверхности соприкосновения двух металлов не имеет значения (отсюда Вольта правильно заключил, что электропроводность металлов во много раз превышает электропроводность жидкостей). Эти наблюдения были сделаны все еще с помощью лягушечьего препарата. Но в 1796-97 гг. Вольта стал пользоваться для констатирования электрического состояния тел электроскопическим методом; тут ему удалось экспериментально подтвердить свое прежнее предположение об электризации проводников при простом соприкосновении. Так как эта электризация весьма слаба, то обнаружение ее является довольно тонким опытом.
Один из простейших способов обнаружить электризацию при соприкосновении (контакте) двух металлов состоит в следующем. Цинковая и медная пластинки, снабженные изолирующими ручками, отделены друг от друга изолятором - тонким листочком слюды или слоем лака - и, следовательно, представляют конденсатор. Соединим обе пластинки друг с другом посредством медной проволоки (причем они получат определенную разность электрических потенциалов и, вследствие значительной емкости образуемого ими конденсатора, будут содержать сравнительно большое количество электричества); затем уберем эту соединительную проволоку и отнимем пластинки одну от другой; при этом, вследствие уменьшения емкости, значительно возрастет разность потенциалов между пластинками, и с помощью электроскопа нетрудно будет убедиться в их электрическом состоянии: цинковая пластинка обнаружит положительную электризацию, медная - отрицательную. (Что касается развивающейся в опыте разности потенциалов между пластинками во время их соприкосновения, то она оказывается зависящей только от природы соприкасающихся тел, но не зависит от их размеров, формы, а равно и от величины поверхности соприкосновения). Делая опыты над различными металлами, Вольта нашел, что все они могут быть расположены в ряд (так называемый ряд Вольта), обладающий тем свойством, что при соприкосновении любых двух металлов из этого ряда тот, который стоит ближе к началу ряда, электризуется положительно, а другой - отрицательно, и чем дальше друг от друга помещаются два члена ряда, тем сильнее электризация. У разных исследователей порядок членов в этом ряду оказывается не совсем одинаковым, что может объясняться различной степенью чистоты проводника, неодинаковым физическим состоянием поверхности и т. д. Если ограничиться наиболее бесспорными данными, то получим ряд Вольта в следующем виде:
+
Цинк
Свинец
Железо
Медь
Серебро
Золото
Платина
Уголь
-
Любопытно, что различные вещества идут здесь в порядке убывающей окисляемости или (по отношению к металлам) в порядке возрастающего благородства. Пользуясь понятием контактной разности потенциалов, можно изложить указанный выше закон Вольта в более общей и более точной форме таким образом: представим себе несколько проводников первого класса А, В, С, ... L, М, соединенных последовательно друг с другом в (незамкнутую) цепь. В таком случае разность потенциалов между двумя крайними проводниками А и М будет такая же, как если бы оба эти проводника были в непосредственном соприкосновении. Если оба проводника, находящиеся на концах цепи, имеют тождественную природу, то концы цепи имеют один и тот же потенциал; замкнув такую цепь, мы не получим никакого течения электричества (причем предполагается, что все контакты имеют одинаковую температуру). Иначе обстоит дело, если в цепи находятся проводники второго класса: в этом случае при замкнутой цепи (как уже было сказано) получается течение электричества, а при разомкнутой цепи можно неопределенно увеличивать разность потенциалов между ее концами посредством увеличения числа ее членов. Это осуществляется в т. н. Вольтовом столбе, который был изобретен Вольта в конце 1799 г. и представляет первую по времени гальваническую батарею.

Вольтов столб (рис. 2) состоял из ряда серебряных (или же медных), цинковых и суконных (или кожаных, папковых) кружочков, причем последние слегка увлажнялись щелочным раствором или просто водой (не дистиллированной, следовательно содержащей соли). Кружочки складывались в таком порядке: медь - цинк - вода - медь - цинк - вода - медь - и т. д.
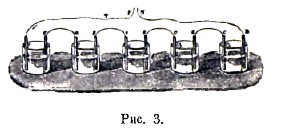
Одновременно со столбом Вольта изобрел батарею из банок (рис. 3); в каждую банку наливалась теплая вода или соляной раствор и опускалась серебряная (О) и цинковая (Z) пластинки, которые не должны были касаться друг друга. Каждая цинковая пластинка одной из банок соединялась металлическим крючком с серебряной пластинкой следующей банки. От этих приборов Вольта получил довольно сильные физиологические действия на человеческий организм.
Изобретение гальванической батареи составляет кульминационную точку в трудах великих деятелей гальванизма. После этого открытия следовал, как бы с неизбежностью, ряд других, также необыкновенно важных: открытие электролиза (Карлейль и Никольсон, 1800), электрической («вольтовой», см.) дуги (Петров, 1803, и независимо от него Дэви, не позднее 1813), электромагнетизма и электродинамики (Эрстед, 1820; Фарадей, 1821; Ампер, 1821), термоэлектричества (Зебек, 1821); изобретение электромагнита (Стерджен, 1825); установление Омом своего закона (1827) - до открытия индукции токов (Фарадей, 1831), которое можно считать за начало новой великой эпохи.
Гальванические элементы. Гальваническим или гидроэлектрическим элементом можно назвать всякую комбинацию проводников, способную превращать присущий ей запас химической энергии в энергию электрическую. Элементы строятся почти всегда или из трех, или из четырех проводящих тел; в том и другом случае в состав их входят два металла (вообще - два проводника первого класса), которые носят название электродов или полюсов. Для определенности представлений будем говорить о каком-нибудь одном элементе, например, о вышеописанном элементе Вольта. Здесь электродами служат медь и цинк, погруженные в электролитическую жидкость (например, раствор серной кислоты в воде). Часто говорят, что медь бывает здесь наэлектризована положительно, цинк - отрицательно. Это не точно уже потому, что мы можем наэлектризовать весь элемент до какого-нибудь достаточно высокого потенциала и таким образом получить на обоих электродах положительную электризацию (причем основное свойство элемента, как машины, превращающей химическую энергию в электрическую, не потерпит никаких изменений); но это утверждение вообще не доказано; оно представляет собой не результат эксперимента, а результат теории. Экспериментируя над каким-нибудь элементом, мы всегда к двум (по крайней мере) контактам, имеющимся в нем (так, в элементе Вольта мы имеем контакты: 1) медь - электролит; 2) электролит - цинк), прибавляем еще, по меньшей мере, один (например, соединяем полюсы элемента медной проволокой: тогда прибавляется контакта цинк - медь; или же сообщаем полюсы элемента с квадрантным электрометром, причем осуществляется подобное же обстоятельство). Итак, оставаясь на почве эксперимента, мы не должны упускать из вида существование этого добавочного контакта; и если мы говорим об элементе Вольта, то кроме составных частей, указанных выше, мы должны еще вообразить, например, медную проволоку, припаянную к цинковому электроду; таким образом, обе свободные оконечности элемента будут состоять из одного и того же материала. В этом случае фактическая сторона дела будет такова: потенциал медного электрода будет приблизительно на один вольт выше, чем потенциал медной проволоки, припаянной к цинковому электроду. Эта разность потенциалов однородных оконечностей нашего элемента называется его электродвижущей (электровозбудительной) силой. Опыты показывают, что электродвижущая сила элемента не зависит ни от формы и размеров его, ни от его возможной электризации (в целом), а только от природы составляющих его проводников и от физического состояния (температуры, давления) их. У большинства употребительных элементов электродвижущая сила составляет от одного до двух вольт; таким образом, мы имеем здесь электрическое напряжение, которое в несколько сот раз меньше напряжения, получающегося при натирании смолы или эбонита сукном. Этим объясняется то обстоятельство, что элемент не в состоянии дать действий, характерных для электричества, развиваемого трением; поэтому только соединением многих элементов Вольта мог добиться сколько-нибудь значительных физиологических действий.
Тот из электродов элемента, который имеет потенциал более высокий, чем проволока из того же металла, припаянная к другому электроду, называется положительным электродом (полюсом); другой же - отрицательным. В элементе Вольта цинк служит отрицательным электродом, медь - положительным. Положительный электрод называют также катодом, отрицательный - анодом; такая терминология употребляется, когда рассматривают процессы в элементе; если же рассматривается процесс во внешнем проводнике (например, проволоке, трубке, электролитической ванне), включенном между полюсами элемента или батареи, то - наоборот - зовут положительный полюс анодом, а отрицательный - катодом (эти термины введены Фарадеем. По-гречески άνά значит вверх, χατά - вниз, όδός - путь). Замкнуть элемент, значит соединить его электроды друг с другом при помощи какого-нибудь проводника. При этом, вследствие существования некоторой разности потенциалов на концах проводника, получится непрерывное течение электричества, как в этом проводнике, так и внутри элемента, или гидроэлектрический (гальванический) ток (причем + электричество течет от анода к катоду; это направление называется направлением тока). Ток прекращается при размыкании цепи, составленной из элемента и проводника, введенного между электродами (т. е. при прекращении проводящего сообщения анода с катодом).
Элементы могут быть разделены на две категории: непостоянные и постоянные. Замкнув элемент, состоящий из цинка, платины и раствора серной кислоты в воде, мы заметим, что ток его, вначале весьма сильный, очень быстро ослабевает до нуля; это явление связано с химическими процессами внутри элемента во время прохождения тока; в результате этих процессов на платине, служащей положительным электродом, выделяется водород, вследствие чего исчезает электрическая разность между этим электродом и другим: электродвижущая сила элемента убывает. Это явление называется гальванической поляризацией. Сюда присоединяется еще другое обстоятельство: вследствие выделения газов в элементе увеличивается внутреннее сопротивление его; это опять-таки влечет за собой ослабление тока, даваемого элементом. К таким поляризующимся или непостоянным элементам принадлежат вообще элементы, состоящие из двух проводников первого класса и одной жидкости. Непостоянными элементами можно пользоваться лишь в течение короткого времени или же для получения самых слабых токов; в противном случае следует прибегать к постоянным элементам. Для того, чтобы элемент из трех тел сделать более постоянным, употребляют следующие средства: 1) амальгамируют металл, служащий катодом; при этом он растворяется в жидкости только в той мере, в какой это необходимо; 2) растворяют в жидкости какое-нибудь вещество, легко отдающее кислород, с которым химически соединялся бы выделяющийся водород (примером служит хромовый элемент); 3) окружают положительный электрод веществом, содержащим много кислорода (пример - купрон-элемент). Добавочные вещества, служащие для устранения поляризации, зовутся деполяризаторами. Большая степень постоянства, сравнительно с предыдущими случаями, достигается, если к двум электродам и одной жидкости предыдущих элементов добавить еще другую жидкость, надлежаще подобранную и служащую деполяризатором. Две жидкости или непосредственно соприкасаются между собой, находясь - одна вверху, другая внизу, согласно с их удельным весом, или же отделяются друг от друга пористой перегородкой, которая препятствует их быстрому смешиванию и в то же время пропускает ток (пример - элемента Даниеля).
Абсолютно постоянного элемента быть не может, вследствие неизбежного смешения жидкостей посредством диффузии и вследствие вызываемых током изменений концентрации.
Вопрос о постоянстве элемента ставится особенно решительно при устройстве так называемых нормальных элементов, которые служат не как источники тока, а как неизменные образцы, или эталоны электродвижущей силы при лабораторных исследованиях. К нормальному элементу предъявляются следующие главные требования: 1) он должен состоять из веществ, легко получаемых в совершенно чистом виде; 2) его электродвижущая сила не должна изменяться с течением времени и должна, возможно, меньше зависеть от температуры. Употребляется такой элемент только или в разомкнутом состоянии (электрометрически), или замкнутым чрез очень большое сопротивление (десятки тысяч ом), да и то в течение самого короткого времени. В настоящее время наиболее распространен т. н. нормальный элемент Уэстона (рис. 4).

Электроды, которыми служат амальгама кадмия (-) и небольшое количество чистой ртути (+), находятся на дне двух стеклянных трубок, соединенных в форме буквы Н. Поверх ртути положено тесто из сернокислого кадмия CdSO4 и сернокислой ртути Hg2SO4; жидкостью служит насыщенный раствор сернокислого кадмия. Обе трубки залиты парафином и закрыты пробками. Платиновые проволочки, впаянные в дно трубок, служат для введения элемента в цепь. Электродвижущая сила равна (при 18°) 1,0187 вольта; она почти не зависит от температуры.
При выборе элемента для той или иной цели, кроме степени постоянства, приходится принимать во внимание еще следующие обстоятельства. Сила действия элемента зависит, главным образом, от природы электродов и от величины внутреннего сопротивления. Для получения возможно большей электродвижущей силы следует брать в качестве электродов по возможности более удаленные друг от друга члены Вольтова ряда (см. выше); в особенности подходящие алюминий, цинк, свинец для катода, и уголь, платина, серебро, медь - для анода. Род жидкости мало влияет на величину электродвижущей силы. Если желательно уменьшить внутреннее сопротивление элемента, то поверхности соприкосновения проводников, входящих в его состав, должны быть, возможно, большими, а расстояние между электродами - возможно малым. Имеет большую важность тщательное содержание элементов. Металлические поверхности должны быть отчищены - либо механическим путем, либо посредством погружения в разведенную серную кислоту; если они амальгамируются, то это производится либо натиранием их ртутью при помощи жесткой щетки или шерстяной тряпки, либо погружением в раствор ртутной соли. Угли должны быть очищены механически (подпилком) и путем накаливания. Глиняные пористые горшки, служащие для отделения двух жидкостей друг от друга, должны быть после употребления помещаемы в воду, чтобы поры не закупоривались. Никогда не следует держать элемент замкнутым, если это не необходимо.
Переходя к описанию отдельных элементов, заметим вообще, что практическое значение гидроэлектрических элементов, как источников тока, делается в последнее время все меньше и меньше; употребление их ограничено почти исключительно целями сигнализации (телеграфия, телефония, звонки). Для лабораторных работ в настоящее время пользуются, главным образом, или токами динамо-машин, или же употребляют аккумуляторы, представляющие то удобство, что их электродвижущая сила остается почти постоянной в течение целых часов. Поэтому мы ограничимся описанием сравнительно немногих разновидностей из огромного числа элементов, которые когда-либо были предложены. Элементы с одной жидкостью. В качестве отрицательного электрода служит почти всегда цинк. Элемент Вольта неоднократно уже упоминался.
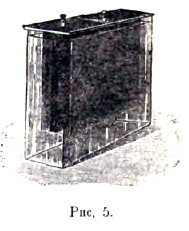
В так называемом купрон-элементе (см. рис. 5) положительным полюсом служит пористая пластина медной окиси, помещающаяся в широком и коротком стеклянном сосуде между двумя цинковыми пластинами, металлически сообщенными между собой и представляющими отрицательный полюс. Оба электрода прикреплены к каучуковой доске, служащей крышкой. Сосуд наполняется 15-18% раствором едкого натра (или едкого кали). Когда элемент замкнут, окись меди постепенно восстанавливается в закись или в чистую медь. После того как восстановление зашло достаточно далеко, надо вынуть электроды из сосуда, промыть их и оставить на сутки в теплом месте; при этом медь или медная закись положительного электрода сама собой снова окисляется в окись. Цинк постепенно растворяется в жидкости, поэтому раствор едкого натра надо менять время от времени. Электродвижущая сила весьма постоянна и равна 0,85 вольта; внутреннее сопротивление весьма мало.
Еще чаще, чем медь, употребляется в качестве положительного электрода уголь, а именно, так называемый ретортный уголь, оседающий на наиболее горячих местах внутри реторт газовых заводов или изготовляемый искусственно. Он весьма тверд и прочен и при этом очень порист; благодаря последнему свойству он дает кислороду воздуха свободный доступ к выделяемому током водороду, чем ослабляется поляризация; кроме того, пористость придает ему большую поверхность соприкосновения с жидкостью, вследствие чего усиливается ток. Благодаря этим качествам, а также дешевизне угля, угольные элементы являются самыми распространенными.

На рис. 6 изображена латунная арматура, служащая для соединения угольной пластины с проводом. Для непродолжительных, но довольно сильных токов удобен хромовый элемент Бунзена. Он состоит из амальгамированного цинка и ретортного угля в водном растворе серной кислоты и двухромокислого калия (хромпика), K2Cr2O7; серная кислота является действующим веществом, хромпик играет роль деполяризатора. Состав раствора по Бунзену выражается отношением - хромпик:серная кислота:вода = 1:2:12 (весовых частей). Другие предлагали отношения - 1:2:8, 1:3:7, 1:2:3, 1:1:3, или такой состав: на 1 литр воды 100 граммов хромпика и 100 куб. см серной кислоты. Вместо двухромокалиевой соли можно взять более дешевую и сильнее действующую двухромонатриеву соль. Рекомендовано также прибавление соляной кислоты.
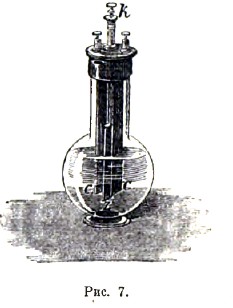
Одну из разновидностей хромового элемента представляет весьма известный элемент Грене (рис. 7); здесь цинк Z находится между двумя угольными пластинками СС, металлически сообщенными друг с другом; эти электроды прикреплены к каучуковой крышке сосуда, причем цинк сделан подъемным с помощью палочки k; его опускают в жидкость только на время действия элемента, чтобы он не разъедался без пользы. Сосуд имеет форму графина с широким горлом. Элемент Грене, благодаря простоте обращения с ним, часто применяется в электротерапии. Электродвижущая сила - около 2 вольт.
Элемент Лекланше весьма пригоден во всех случаях, где нужно бывает получить без промедления не особенно сильные, кратковременно длящиеся токи: для звонков, для домовых телеграфов, телефонов, маленьких (карманных) калильных лампочек, наконец, при электрических измерениях. Этот элемент изготовляется в двух разновидностях: 1) в стеклянном стакане находится насыщенный раствор нашатыря; сюда опущена цинковая палочка (катод) и глиняный пористый горшок, внутри которого находится угольный стержень (анод), окруженный перекисью марганца (деполяризатор). Такой элемент изображен на рис. 8. 2) Необходимость в пористом сосуде отпадает, если в качестве анода употребляется так называемый «агломерат», представляющий смесь из 40 частей перекиси марганца, 55 частей ретортного угля и 5 частей шеллака (служащего связующим средством), спрессованную при температуре 250°. Агломерат обыкновенно имеет форму толстого цилиндра и находится посредине сосуда, цинковая палочка - сбоку. Электродвижущая сила - около 1,5 вольта.

Одну из распространенных форм элемента Лекланше представляют так называемые сухие элементы (было бы правильнее называть их влажными), в которых жидкость впитана желатиной, гипсом, песком, древесными опилками и т. д., так что можно безопасно помещать элемент в любое положение. Чаще всего сосуд такого элемента изготовляется из цинковой жести и служит отрицательным электродом; посредине находится агломерат - положительный электрод. Сверху элемент залит смолой, во избежание испарения жидкости; оставляется лишь маленькое отверстие. Внешний вид сухого элемента показан на рис. 9.

Уорен построил элемент, имеющий электродвижущую силу в 3 вольта (уголь с содержанием бора и цинк в растворе марганцовой соли). Яблочков устроил элемент из сложенных пластинок угля и натрия, действовавший под влиянием влажности воздуха и дававший 4 вольта; этот интересный элемент, конечно, не может иметь практического значения.

Элементы с двумя жидкостями. Элемент Даниеля (рис. 10). В стеклянную банку налит насыщенный раствор медного купороса; в него погружен медный цилиндр K (положительный электрод); здесь же находится пористый сосуд Т, содержащий внутри 5-10% раствор серной кислоты или разведенный раствор цинкового купороса и амальгамированный цинковый цилиндр Z (отрицательный электрод). Винт s и вырезка m позволяют соединить медь одного элемента с цинком другого (последовательное соединение). Электродвижущая сила - от 1,08 до 1,12 вольта, в зависимости от концентрации растворов. Элемент Даниеля довольно постоянен; но употребление его сопряжено с неудобствами. Жидкости мало-помалу смешиваются путем диффузии; на пористой перегородке может отлагаться медь; поэтому после употребления приходится всякий раз разбирать элемент и особенно тщательно промывать пористый сосуд. От этих недостатков свободно видоизменение элемента Даниеля, предложенное Мейдингером (рис. 11).

Стеклянная банка А суживается внизу; в более широкой, верхней части ее находится цинковый цилиндр Z; на дне банки А стоит стеклянный сосуд d, в котором помещается медный цилиндр е; отходящий от него провод g окружен изолирующей трубкой (каучуковой или стеклянной). Сосуд d наполнен насыщенным раствором медного купороса; над ним висит, опираясь на крышку сосуда А, стеклянная воронка h (или баллон) с отверстием внизу, наполненная кристаллами медного купороса; поверх раствора медного купороса в сосуд А осторожно наливают раствор горькой соли (сернокислой магнезии), который, будучи более легким, остается наверху, а в воронку h наливают воды. По мере разложения жидкости в маленьком стакане d, туда опускаются из h новые количества насыщенного раствора медного купороса. Электродвижущая сила - 1,2 вольта, сопротивление велико - около 3 и более ом. Он удобен в тех случаях, когда нуждаются не в сильном, а в частом и продолжительном токе, например, для телеграфного дела. Распространен в России. Элементы Буффа, Крамера, Карре, У. Томсона, Сименса и Гальске, Варли, Минотто, Труве, Калло, Крюгера также представляют собой видоизменения Даниелева элемента.
Из элементов с двумя электролитами, имеющих уголь положительным полюсом, важнейшим является элемент Бунзена. Он состоит из цинка в разбавленной серной кислоте (1 часть на 12 частей воды) и угля в крепкой азотной кислоте (удельного веса 1,35); жидкости разделены пористым сосудом. Выделяет вредные пары азотноватого ангидрида, которые, между прочим, портят медные зажимы; поэтому лучше делать металлические соединения из свинца, а самые элементы необходимо держать под воздушной тягой (в особом помещении или в камине). Имея значительную электродвижущую силу (1,75 вольта) и малое внутреннее сопротивление (от 1/10 до 1/100 ома), оказывает весьма сильное действие.
Прототипом элемента Бунзена был элемент Грова, где положительным полюсом служит платиновый лист, остальные части - те же, что у Бунзена; действие еще лучше, чем у Бунзена, но дорогая цена платины, конечно, была препятствием широкому распространению этого элемента. Некоторые заменяли уголь железом; другие, наоборот, заменяли железом (или алюминием) цинк. Заметим, что в элементе с двумя жидкостями можно взять оба металла одинаковыми; можно даже употреблять одну и ту же жидкость, только в двух различных концентрациях; это - так называемые концентрационные элементы, не имеющие практического значения вследствие слабости их, но весьма важные в теоретическом смысле, так как их действие может быть предвычислено.
Упомянем, наконец, о следующей интересной идее, которую в особенности Эдисон старался поставить на практическую почву. Во всех элементах при действии их расходуется металл, служащий отрицательным полюсом (обыкновенно цинк). Чтобы извлечь этот металл из руды, нужно было обжигать руду с углем, который при этом также расходуется; при этом теряется без пользы огромное количество энергии. Нельзя ли миновать металл, как промежуточную инстанцию, и добывать электрическую энергию, непосредственно расходуя уголь в элементе? Этот вопрос до сих пор не получил практического решения, и некоторые даже считают такое решете маловероятным. К элементам, построенным на вышеуказанном принципе, принадлежит элемент Яблочкова: в чугунном горшке расплавляется селитра, и туда опускается угольная палочка. При этом уголь окисляется на счет кислорода селитры и является отрицательным полюсом, а чугун - положительным. Еще раньше подобный элемент был устроен Бекрелем.
Газовые элементы. При соприкосновении газа с твердым телом получается контактная разность потенциалов; отсюда вытекает возможность устройства элементов, в которых один электрод или даже оба электрода будут газообразными телами. Наиболее простой способ осуществления газового элемента мы имеем в газовом вольтаметре (см.): при пропускании тока чрез вольтаметр, платиновые пластинки его поглощают некоторые количества выделяющихся газов (водорода и кислорода); если теперь, выключив батарею, замкнуть вольтаметр чрез гальваноскоп, то обнаружится присутствие тока, причем платина, поглотившая кислород, играет роль положительного полюса. Элементы, осуществляемые посредством предварительного пропускания тока чрез известную систему тел (как в примере вольтаметра), называются поляризационными или вторичными; к типу вторичных элементов принадлежит, между прочим, аккумулятор (см.). Можно сделать первичный газовый элемент, если окружить атмосферами двух различных газов две платиновые пластинки, соединенные электролитом (в газовом элементе Грова брались кислород и водород).
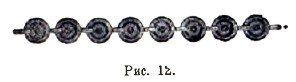
Гальванические батареи. Когда с помощью элементов желают получить более сильное действие, то соединяют их в батареи; уже Вольтов столб дает нам пример такого соединения. Существуют два главных способа соединения элементов: последовательный (или в ряд) и параллельный. При последовательном способе соединяют катод каждого элемента с анодом следующего (рис. 12), как в столбе или батарее Вольта; полюсами батареи будут служить свободные электроды первого и последнего элемента; электродвижущая сила батареи будет равна сумме электродвижущих сил элементов, и сопротивление - сумме сопротивлений элементов. Подобного рода батарею представляет, между прочим, т. н. сухой или Замбониев столб. Каждый элемент состоит здесь из кружочка так называемой золотой бумаги (медь) склеенного своей бумажной стороной, при помощи клейстера, с бумажной же стороной кружочка из так называемой серебряной бумаги (олово). Несколько тысяч таких элементов укладываются друг на друга внутри хорошо изолирующей стеклянной трубки так, чтобы один и тот же металл всегда был обращен в одну и ту же сторону, и крепко сжимаются двумя латунными колпачками k и h, закрывающими концы трубки (рис. 13).

Для действия столба необходимым условием является влажность бумажной и клеевой прослойки между листочками металлов. Тогда на концах столба получается довольно значительная разность потенциалов (десятки вольт). Ток, даваемый столбом, вследствие большого сопротивления бумаги, слабее, чем даже токи электростатических машин; впрочем, сухой столб употребляется исключительно для заряжения электроскопов или электрометров.

Параллельное соединение элементов изображено на рис. 14: здесь все катоды соединяются между собой и все аноды между собой; катодом (анодом) батареи будет служить катод (анод) любого элемента (предполагается, что все элементы имеют тождественное устройство). Легко сообразить, что параллельная батарея представляет как бы один большой элемент с расчлененными электродами; поэтому электродвижущая сила батареи здесь равна электродвижущей силе одного элемента. Сопротивление n равных элементов, соединенных в параллель, составляет n-ую долю сопротивления одного элемента.
Расчет, легко производимый на основании закона Ома, показывает, что последовательная батарея дает наиболее сильный ток тогда, когда сопротивление внешнего проводника, соединяющего полюсы батареи, весьма велико по сравнению с внутренним сопротивлением батареи (например, на телеграфных линиях); наоборот, параллельное соединение бывает выгодно тогда, когда сопротивление внешнего проводника мало сравнительно с сопротивлением батареи (как, например, при гальванокаустике). В промежуточных случаях для получения наиболее сильного тока выгоднее всего группировать элементы в параллельные ряды, а именно так, чтобы сопротивление внешнее и внутреннее были по возможности ближе к равенству. На рис. 15 показаны два параллельно соединенные ряда из четырех элементов каждый.

В истории физики известны примеры батарей из чрезвычайно большого числа элементов. Петербургский профессор Петров в 1802 г. производил опыты с батареей из 4 200 цинковых и медных кружков; Деви в 1808 г. построил батарею из 2 000 элементов Вольта; Уорен де ла-Рю и Мюллер построили батарею из 11 000 элементов цинк-серебро в растворе поваренной соли, с хлористым серебром в качестве деполяризатора. По своим свойствам такая батарея приближается к тем источникам высокого потенциала, какими являются электростатические машины: она дает искру около 1 сантиметра длиной.
Теоретические воззрения на причины и сущность гальванических явлений. Во время действия элемента, в нем исчезает некоторое количество потенциальной химической энергии, вследствие происходящих химических реакций; с другой стороны, появляется некоторое количество энергии электрической, которая может превратиться или во внешнюю работу или в (так называемую Джоулеву) теплоту, развивающуюся при прохождении электрического тока по проводникам, и т. д. Естественно попытаться сбалансировать количества энергии исчезающей и появляющейся. Для определенности представлений будем говорить об элементе Даниеля. Если этот элемент замкнуть проводником, то цинковый электрод разъедается все более и более: цинк переходит в раствор, образуя цинковый купорос ZnSO4. Наоборот, медный электрод все более утолщается: из раствора медного купороса CuSO4 выделяется количество меди, эквивалентное количеству растворившегося цинка. При образовании ZnSO4 выделяется энергия; при разложении CuSO4 она поглощается, но в меньшем количестве, так что, в общем, мы имеем выделение энергии. Количества растворившегося цинка и выделившейся меди пропорциональны количеству электричества, протекшему через элемент (см. электролиз); допустим, что это количество электричества равно 1 кулону; тогда в элементе растворится 0,00034 г цинка и восстановится 0,00033 г меди. Происходящие здесь химические превращения равносильны тому, как если бы мы цинковую палочку опустили в раствор медного купороса: здесь также цинк переходит в раствор и дает ZnSO4, замещая эквивалентное количество меди, выделяющейся из CuSO4 и оседающей на погруженном цинке; также выделяется и энергия в виде теплоты; количество энергии, выделяющееся при замещении известного количества меди эквивалентным количеством цинка, может быть измерено при помощи калориметра. На основании подобного измерения мы будем знать, какое количество химической энергии выделяется в элементе при прохождении 1 кулона; пусть это количество энергии равно q джоулей. С другой стороны, если по замкнутой цепи, в которой имеется электродвижущая сила в Е вольт, протекает 1 кулон, то электрические силы совершают работу в Е джоулей (ибо работа электрических сил равна 1 джоулю всякий раз, когда 1 кулон, так сказать, «падает с высоты 1 вольта»). На основании закона сохранения энергии, естественно сделать вывод, что Е = q, т. е. что электродвижущая сила элемента составляет столько вольт, сколько джоулей выделяется при реакциях, происходящих в нем при протекании одного кулона. Это - так называемое правило Томсона, оправдывающееся на опыте для элемента Даниеля, для кадмиевого элемента Уэстона и для некоторых других; для элементов этой категории можно теоретически высчитать электродвижущую силу из теплового эффекта химических реакций, происходящих в элементе. Однако так бывает не всегда. У большинства элементов электрическая энергия меньше теплового эффекта химических реакций (E<q); у других она, наоборот, больше (Е>q). В первом случае элемент во время действия нагревается; во втором он охлаждается, заимствуя теплоту из окружающей среды. Более точная термодинамическая теория, данная Гельмгольцем, показывает, что в этих случаях имеет место следующее более общее соотношение: E=q+T(dE/dT), где Т - абсолютная температура элемента. Эта формула пригодна только для обратимых элементов, т. е. обладающих тем свойством, что химические процессы в них пройдут в обратном порядке, если через них будет пропущен ток какого-нибудь внешнего источника в обратном направлении (так, например, элемент Даниеля относится к обратимым: если пропустить через него ток от меди к цинку, то медный электрод будет растворяться, а на цинковом будет выделяться цинк). Из последней формулы, между прочим, видно, что правило Томсона Е=q справедливо тогда, когда электродвижущая сила обратимого элемента может считаться не меняющейся в зависимости от температуры (как это приблизительно имеет место для элементов Уэстона, Даниеля); если с повышением температуры электродвижущая сила элемента возрастает, то dE/dT>0, Е>q и наоборот. Предыдущая теория покоится на незыблемой основе термодинамики и не имеет в себе ничего гипотетического; этого нельзя сказать про теории, имеющие своей целью объяснение явления электродвижущей силы при контакте тел; в этой области до сих пор достигнуто так же мало согласия между учеными, как было сто с лишком лет назад, в эпоху споров Гальвани и Вольты (хотя центр тяжести спора теперь переместился). Является не установленным основное обстоятельство. Пусть мы имеем элемент, к электродам которого припаяны проволоки из одного и того же металла. Тогда между этими проволоками будет налицо разность потенциала Е, равная электродвижущей силе элемента. Несомненно, что существование этой разности потенциала обусловлено контактом разнородных тел. Но у нас имеется, по крайней мере, три таких контакта: например, если рассматриваем элемент Вольта, и если проволоки, соединенные с электродами, медные, то эти контакты будут: 1) медь - цинк, 2) цинк - электролит, 3) электролит - медь. У каждого из этих контактов может быть (по всей вероятности, и есть) известная разность между потенциалами соприкасающихся тел. Но как велика каждая из этих трех разностей? в какой мере каждая из них участвует в создании совокупной разности Е? Этот вопрос до сих пор не решен, или, лучше сказать, отдельные ученые или группы ученых решают его по своему: одни так, другие иначе.
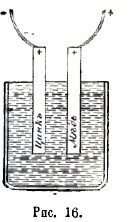
По одному воззрению (примыкающему непосредственно к взглядам Вольта) дело обстоит, как показано на черт. 16: между цинковым электродом и медной проволокой существует скачек потенциала в смысле опыта Вольта (это символически обозначено знаком + у цинка Zn, знаком - у припаянной к нему медной проволоки); могут быть скачки и в других двух местах контакта, но они имеют второстепенное значение (поэтому у меди Cu стоит, как и у цинка, знак +). В общем, медные проволоки, припаянные к электродам, «обнаруживают разноименную электризацию», хотя оба электрода наэлектризованы одинаково. Самое возникновение электризации при соприкосновении разнородных металлов может быть объяснено так: всякое металлическое тело содержит определенное количество свободных атомов отрицательного электричества - электронов, - которые хаотически летают в нем, подобно молекулам газообразного тела; своими столкновениями с частицами металла и друг с другом эти электроны, подобно газовым молекулам, создают известное давление, величина которого зависит от температуры и от природы металла в цинке это давление «электронного пара» больше, чем в меди. Поэтому, при соприкосновении цинка с медью, электроны устремляются из цинка в медь; цинк, потерявший некоторое количество электронов, делается наэлектризованным положительно, медь же, принявшая их, - отрицательно.

По другому воззрению (разделяемому, между прочим, школой Нернста) в элементе Вольта происходит следующее: цинк Zn и медь Cu, опущенные в электролит, электризуются разноименно: цинк отрицательно, медь положительно (рис. 17); скачок потенциала имеет место на поверхностях соприкосновения электродов с электролитом; а если мы припаяем к цинку медную проволоку, то сколько-нибудь значительного скачка потенциала здесь не будет. Явление Вольта (электризация металлов при соприкосновении) объясняется в этой теории не свойствами самих металлов, а действием окружающей эти металлы среды - воздуха. Объяснение электризации металла при соприкосновении его с электролитом, по Нернсту, состоит в следующем. С одной стороны, известно, что ионы металлов всегда несут на себе положительный заряд; с другой стороны, всякий металл должен, хотя в минимальной степени, быть способным к растворению в воде, ибо нет тел абсолютно нерастворимых. Нернст допускает, что частицы металла поступают в раствор в форме ионов: это значит, что нейтральное электричество погружаемого в воду металла разлагается; положительное (в надлежащей пропорции) связывается со вступающими в раствор частицами, отрицательное же образует собой заряд на погруженном куске металла. Таким образом, раствор электризуется положительно, металл - отрицательно. Это - теория электродвижущей силы соприкосновения. Самое растворение металла происходит под действием как бы некоторой силы, побуждающей металлические ионы распространяться в разные стороны и, следовательно, аналогичной силе упругости газов; ее называют упругостью растворения. В случае растворения такого тела, которое, как, например, сахар, переходит в воду в форме электрически-нейтральных молекул, действию силы упругости растворения полагает предел наступающее насыщение раствора; иными словами, здесь она уравновешивается осмотическим давлением насыщенного раствора. При растворении же металлов ей противодействуют появляющиеся электростатические взаимодействия. Именно, поступившие уже в раствор положительные ионы металла мешают поступать туда новым положительным ионам, ибо действуют на них отталкивающе; с другой стороны, погруженный в раствор кусок металла, имея развившийся на нем отрицательный заряд, сам оказывает притяжение на плавающие в растворе ионы. Эти электростатические силы успеют уравновесить силу упругости растворения раньше, нежели в раствор перейдет доступное измерению количество металла, ибо электрические заряды ионов огромны сравнительно с их массой. Такое равновесие наступает, если кусок благородного металла, например, серебра, погружать в раствор солей. Бывают иные случаи: если погрузить кусок железа в раствор медной соли, то ионы меди, с одной стороны, толкаемые одноименно наэлектризованными ионами железа, поступающими в раствор, с другой - притягиваемые разноименно - наэлектризованным куском железа, осядут на этом последнем. Из этого, очевидно, следует, что упругость растворения железа больше упругости растворения меди, что иначе выражается так: медь благороднее железа. Это - теория вытеснения одного металла другим.
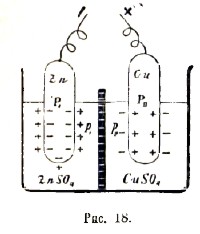
Рассмотрим, наконец, теорию гальванического элемента, например, элемента Даниеля. Мы имеем (рис. 18) цинковую палочку в растворе соли цинка (например, ZnSO4 - тогда раствор будет содержать ионы Zn и SO4) и медную - в растворе соли меди (например, CuSO4 - в растворе будут ионы Cu и SO4); оба раствора разделены пористой перегородкой. Цинк имеет значительную упругость растворения Р1, которая во всяком случае превышает осмотическое давление p1, производимое ионами цинка в растворе ZnSO4 (иначе говоря, - если даже раствор в левой камере нашего элемента является насыщенным относительно соли ZnSO4, - он все же не насыщен относительно ионов цинка). Поэтому цинковая палочка выпустит в окружающий ее раствор некоторое (по предыдущему неизмеримо малое) число ионов цинка, а сама зарядится отрицательно. Относительно меди произойдет обратное: медь, как более благородный металл в сравнении с цинком, имеет меньшую упругость растворения; посему, предполагая р2, или осмотическое давление ионов меди в правой камере, достаточно большим, превышающим упругость растворения Р2 меди в воде, найдем, что на медной палочке осядет некоторое число ионов меди, которые сообщат ей положительный заряд. Если элемент не замкнуть, то ни медные, ни цинковые ионы не перейдут в раствор в сколько-нибудь заметном количестве, благодаря действию электростатических зарядов, развившихся на металлах и растворах. Но стоит лишь соединить медь и цинк металлической проволокой, чтобы развивающиеся на них заряды получили возможность тотчас же выравниваться, нейтрализуя друг друга: положительное электричество будет двигаться в этой «внешней части цепи» от меди к цинку, отрицательное - в обратном направлении. Тогда уже не будет препятствия постоянному поступанию в раствор новых ионов цинка и пропорциональному осаждению медных ионов на меди, что и происходит при функционировании элемента Даниеля. Ряд следствий, вытекающих из этой теории, оправдывается на опыте. Например, мы видели, что осмотическое давление ионов цинка противодействует упругости его растворения; сила, гонящая ионы цинка в раствор, будет тем больше, чем меньше ионов цинка находится уже в растворе; сила, осаждающая медные ионы на меди, тем больше, чем больше ионов меди имеется в растворе. Чем большее число ионов подвергается перемещении, тем более электродвижущая сила элемента; следовательно электродвижущая сила Даниелева элемента будет тем значительнее, чем слабее (чем менее концентрирован) раствор ZnSO4 и чем сильнее (концентрированнее) раствор CuSO4.
А. Бачинский.
| Номер тома | 12 |
| Номер (-а) страницы | 419 |
