Горение
Горение, химическое явление сопровождающееся выделением света и тепла. В более узком смысле горением называют явление соединения различных веществ с кислородом, сопровождающееся выделением света и тепла. Для того, чтобы какое-либо вещество начало гореть, нужно нагреть его до некоторой определенной температуры, — до его температуры воспламенения. Температура воспламенения различных веществ различна; так, например, желтый фосфор загорается при нагревании всего лишь до 60°С, магний — при нагревании до 800° и т. д. Накаленный уголь, опущенный в кислород, загорается и продолжает гореть. Следовательно, при процессе его горения откуда-то берется теплота, нагревающая его до температуры, при которой он может гореть. Теплота эта получается из химической энергии угля и кислорода; при горении угля, т. е. при процессе его соединения с кислородом, часть запаса химической энергии этих обоих веществ превращается в теплоту, которая и поддерживает дальнейшее горение. При горении какого-либо вещества в чистом кислороде выделяется столько же тепла, сколько и при горении такого же весового количества этого вещества на воздухе. Однако, в первом случае накаливание и свечение будет сильнее. Это происходит от того, что при горении в воздухе выделяемая теплота тратится на нагревание не только горящих веществ и продуктов горения, но и на нагревание не участвующего в горении азота, кроме того при горении на воздухе в единицу времени к горящему веществу притекает меньше кислорода, так как в воздухе последний разбавлен азотом. Как горение веществ на воздухе или в чистом кислороде, т. е. быстрое их окисление, так и медленное окисление (т. е. соединение с кислородом при обыкновенной температуре) сопровождается выделением тепла. При медленном окислении какого-либо вещества выделяется ровно столько же теплоты, сколько при горении такого же весового количества того же самого вещества. Но так как в первом случае процесс протекает медленно, то теплота выделяется понемногу, небольшими порциями, успевает большей частью рассеяться в окружающей среде и не может, поэтому, нагреть окисляющееся вещество до его t° воспламенения. Однако, иногда медленно окисляющиеся на воздухе вещества сами собой воспламеняются. Это самовозгорание происходит тогда, когда куски вещества так сложены в кучу, что выделяющаяся при их медленном окислении теплота задерживается в них. Так, хлопчатая бумага, смоченная маслом и лежащая в больших кучах, часто сама собой воспламеняется.
Твердые вещества горят без пламени. Только при горении газов получается пламя. Когда мы зажигаем свечу, то вещество ее плавится, впитывается фитилем, превращается в газообразное состояние и тогда уже загорается пламенем.
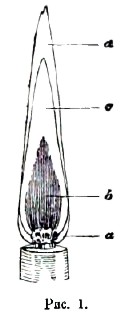
Рис.1.
В пламени свечи легко различить три части (рис. 1). Внутри около фитиля (а) находится темный конус (b) пламени; его окружает светящийся конус (с), и наконец оба эти конуса окружены внешним несветящимся конусом (d). Во внутреннем темном конусе находятся еще не сгоревшие газы. Доказать это можно, внося во внутренний конус один конец изогнутой стеклянной трубки (рис. 2). Тогда газы поднимутся по трубке и могут быть зажжены у ее верхнего конца. Газы эти, полученные при разложении стеарина под влиянием тепла, состоят главным образом из углеводородов. Температура темного конуса настолько невысока, что быстро внесенная туда головка шведской спички долгое время не загорается.
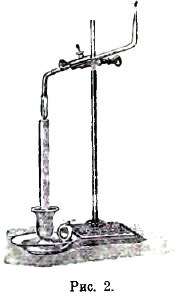
Рис.2.
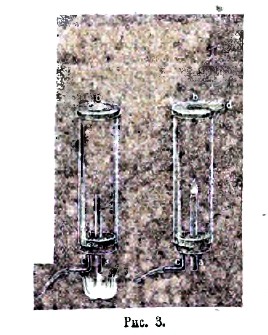
Рис. 3.
В светящемся конусе углеводороды разлагаются с выделением свободного углерода, частички которого накаливаются и, излучая при этом свет, обусловливают собой свечение пламени. Сгорание этих раскаленных частичек происходит во внешнем синеватом (несветящемся) конусе пламени на счет кислорода окружающего воздуха.
Газы, способные гореть на воздухе, называются горючими. Мы говорим, что водород или светильный газ способен гореть на воздухе и в кислороде; но можно устроить так, что кислород или воздух будут гореть в светильном газе. Чтобы показать горение воздуха в светильном газе, поступают так. Через трубку (с) впускают в стеклянный цилиндр (рис. 3), открыв раньше крышечку (d), светильный газ до полного вытеснения воздуха; закрывают отверстие (b) крышечкой (d) и зажигают выходящий из трубки (а) светильный газ (широкое пламя внизу трубки), если открыть теперь отверстие (b), то пламя при (а) становится меньше, подымается по трубке (а) и, дойдя до верхнего конца ее, выворачивается острием вверх; получается, что входящий внутрь цилиндра по трубке (а) воздух горит (пламенем на конце ее) в атмосфере светильного газа. Если бы наша атмосфера состояла из светильного газа, то мы называли бы воздух и кислород горючими газами. Горение прекращается при понижении температуры горящего вещества.
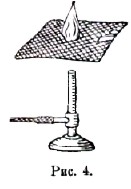
Рис.4.
Если мы будем держать проволочную сетку над газовой горелкой, из которой вытекает газ (рис. 4), и зажжем газ над сеткой, то внизу под сеткой пламени не будет; сетка настолько охлаждает смесь газов, что горение не распространяется вниз. На этом охлаждающем действии металлической сетки основано устройство рудничной предохранительной лампы Дэви (рис. 5).
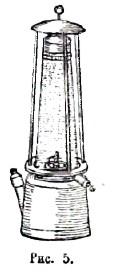
Рис.5.
Пламя этой лампы окружено проволочной сеткой. Если внутрь сетки проникнет взрывчатая смесь рудничного газа с воздухом, то там произойдет небольшой взрыв, но сетка не даст теплоте, выделившейся при взрыве, нагреть смесь, окружающую лампу извне, до t° воспламенения. При горении различных веществ выделяются различные количества тепла. При сгорании водорода, на каждые 18 грамм образовавшегося водяного пара выделяется около 57 000 малых калорий тепла. Поэтому температура водородного пламени очень высока, при горении водорода в чистом кислороде она больше 2 000°.
Сущность явлений горения и вообще окисления была разъяснена Лавуазье (1774 г.). До него эти явления объяснялись при помощи теории флогистона (Сталь, 1723 г.). По этой теории всякое вещество состоит из т. н. «известки» и невесомого огневого вещества — флогистона. Известка каждого вещества отлична от известки других веществ. Вещества, неспособные гореть и вообще окисляться, не содержат флогистона. Окисление и горение состоит в разложении вещества на известку и улетучивающийся при этом флогистон.
С этой точки зрения ржавление железа представляет собой процесс разложения сложного вещества — железа — на ржавчину (известку железа) и флогистон. Лавуазье разъяснил, что явления окисления и горения представляют собой процессы соединения с кислородом. При горении на воздухе или в кислороде получаются соединения с кислородом — окислы. Например, при горении угля получается окисел углерода, при горении металла натрия — окисел натрия и т. д. Л. Писаржевский.
| Номер тома | 16 |
| Номер (-а) страницы | 124 |
