Химия. Химия физическая
III. Химия физическая — «наука, объясняющая на основании положений и опытов физических причину того, что происходит через химические операции в сложных телах». Такое определение дает ей первый физико-химик М. В. Ломоносов, и оно может быть без изменения повторено в настоящее время. К этому М. В. Ломоносов прибавляет: «Она может быть названа химической философией, но в совершенно ином смысле, чем та мистическая философия, где не только не дают объяснений, но даже самые операции производят тайным образом».
Академик П. И. Вальден указывает, что Ломоносов в вопросе о физико-химии является первообразом. «Он первый выдвигает идею о математической и физической химии как самостоятельной науке, он первый составляет систематический курс этой науки, определяя ее цель и содержание, он первый читает публично экспериментальные лекции по этому предмету, и он первый предпринимает удивительно систематизированное опытное изучение фундаментальных вопросов физико-химии». «Если мы сравним гигантскую программу физико-химических опытов Ломоносова с современным состоянием физической химии, например по классическим учебникам В. Оствальда, то нас прямо поразит общность научного материала задуманной Ломоносовым и созданной в продолжение 150 лет физической химии».
Первый труд М. В. Ломоносова по химии, при жизни не напечатанный и сохранившийся в рукописи (относится к 1741 г.), называется: «Elementa Chymiae Mathematicae» («Начала математической химии»). С конца 1751 г. по май 1753 г. Ломоносов читает первый курс химии физической, но к сожалению этот курс не был издан и пролежал в архиве Академии Наук 150 лет и только в XX столетии благодаря трудам профессора Б. Н. Меншуткина появился в свет. Подобные курсы химии физической начали читаться только в последней четверти XIX ст.
Что касается до материала, вошедшего в курсы химии физической, то он накоплялся постепенно в течение столетий теми исследователями, которые подходили к решению химических вопросов с оборудованием и знанием опытного физика. Такими были: Роб. Бойль, Лавуазье и Лаплас, положившие основание термохимии, Бертолле — творец «Химической статики» (1803), Гей-Люссак, Фарадей, Реньо, Бунзен, указавший известным выражением «Der Chemiker, der kein Physiker ist, ist gar nichts» (Химик, который не является физиком — ничто), какое важное значение имеет знание физики для развития химии. У М. В. Ломоносова мысль Бунзена высказана в следующей форме: «Химик без знания физики подобен человеку, который всего искать должен ощупом». Копп, известный историк химии, также произвел ценное исследование физических свойств органических соединений и указал зависимость этих свойств не только от состава, но и от строения соединений. В результате трудов этих и многочисленных других исследователей, получился обширный материал как фактических, так и теоретических сведений, который необходимо было выделить в особый отдел науки — химическую физику. Особенно сильный толчок к дальнейшей разработке физико-химических вопросов дало установление в середине XIX века закона сохранения энергии. Быстрому развитию химической физики 80-х годов XIX ст. особенно содействовал Вил. Оствальд. Еще будучи в Риге в 1885 г., он выпускает 1-ый том «Lehrbuch der allgemeinen Chemie» (2-ой том вышел в 1887 г.), когда он был избран профессором химической физики (первая самостоятельная кафедра по этой науке) в лейпцигском университете.
«Этот учебник», пишет П. И. Вальден, «имеет историческое значение: в нем впервые был дан полный обзор физической (общей) химии». Следует, однако, указать, что еще в 1876 г. Н. Н. Любавин издал свою «Физическую химию». Начало новой химии физической, как самостоятельной науки, считается с 1885 г., «потому что, во-первых, в этом году появилась знаменитая работа Вант-Гоффа о растворенных веществах... и во вторых — в том же году Оствальд издал первый том своего капитального руководства физической химии» (В. Нернст).
В 1887 г. Вант-Гоффом и В. Оствальдом был основан журнал «Zeitschrift für Physikalische Chemie», долгое время остававшийся единственным центральным органом работ по химии физической. С переходом В. Оствальда в лейпцигский университет начался расцвет химии физической. Подобно тому, как некогда (1824—1854) в небольшой городок Гиссен к Либиху съезжались молодые химики со всех концов Европы, так и лейпцигская лаборатория Оствальда (1887—1906) привлекала к себе химиков со всего мира: из нее вышли ученые, приобревшие затем мировую известность: С. Аррениус, Нернст, Бредиг, Джонс, Нойес, Ле Блан и много других. Из русских ученых учениками В. Оствальда в Лейпциге были: Аскан, П. А. Вальден, Н. Д. Зелинский, И. А. Каблуков, В. А. Кистяковский, Лутер, И. Плотников, С. Н. Реформатский, В. Тимофеев, Н. А. Шилов и др. Благодаря трудам В. Оствальда, Вант-Гоффа и их многочисленных учеников химия физическая начала быстро развиваться и проникла во все отрасли естествознания и техники.
В настоящее время химия физическая представляет обширную область науки, распадающуюся на ряд крупных отделов: особенности газообразного и жидкого состояния тел (см. газы и жидкости), растворы (см.), соотношение между физическими свойствами тел и их составом и строением, термохимию (см.), фотохимию (см.), электрохимию (см.), учение о химическом сродстве (см. ниже), о химическом равновесии (см. ниже), коллоидную химию (см. растворы), катализ (см.) и т. д.
Из всех отделов химии физической мы остановимся здесь только на химической кинетике, или учении о скорости реакции.
Еще в XVIII ст. Венцель (1740—1791) измерял скорость действия различных кислот на металлы и предложил на основании этого судить о силе или сродстве кислот. Начало же химической кинетики было положено в 1850 г. Людвигом Вильгельми, исследовавшим скорость инверсии (превращения) тростникового сахара под влиянием различных кислот: было известно, что сахароза (С12Н22О11) в водном растворе распадается на декстрозу (или виноградный сахар, С6Н12О6) и левулозу (или плодовый сахар, С6Н12О6):С12Н22О11 + Н2О = С6Н12О6 + С6Н12О6. Изучая скорость инверсии с помощью поляриметра при различных условиях температуры и концентрации сахара, различных кислот и т. п., Вильгельми вывел математическое выражение для скорости реакции.
Под скоростью химической реакции понимают отношение между количеством превращенного вещества и временем, потребовавшимся для этого превращения. При этом различают реакции: 1) мономолекулярные, когда превращается одно вещество, например, дибромоянтарная кислота (С4Н4Вr2O2) распадается на бромомалеиновую (С4Н3ВrO2) и бромистый водород (НВr):С4Н4Вr2O2 = С4Н3ВrO2 + НВr, или радий распадается на эманацию и α-частицу; 2) бимолекулярные, когда в реакции участвуют два тела, например, омыление уксуснокислого этила едким натром и т. д.; 3) тримолекулярные и т. д. Для вывода уравнения, служащего для вычисления скорости реакции, исходят из предположения, что скорость реакции (иными словами, количество вещества, превращающегося в 1 единицу времени, например 1 минуту) пропорциональна количеству вещества, находящегося в данный момент непревращенным.
Обозначим его через х. Тогда —dx/dt = kx, где k — коэффициент пропорциональности, dх — количество вещества превращенного во время dt. Знак — указывает, что скорость реакции постоянно убывает, так как х делается все меньше и меньше. Если х=1, то —dx/dt = k, т.е. k (константа скорости) показывает, какая часть единицы массы тела превращается в единицу времени, следовательно к является правильной дробью. Опыты над дибромоянтарной кислотой и др. телами показывают, что k является постоянной величиной, откуда можно заключить, что вышеприведенное предположение о зависимости скорости реакции от количества соответствует действительности.
Для того, чтобы определить k для какой-либо реакции, производят ряд наблюдений, отмечая количество прореагировавшего вещества и время, в которое произошло превращение; например, Вант-Гофф нашел для дибромоянтарной кислоты следующие числа:
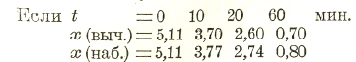
Если обозначим число молей (молекул) вещества в начале опыта через а, в течение же времени t оно превратилось в х молей, то осталось (а—х) неизменным, и согласно вышесказанному имеем: -dx/dt = k(а — х). Интегрируя это уравнение, получаем: — In (а — x) = kt + С, где С — константа интегрирования. При начале опыта — а = 0 и х = - 0, откуда С = Іnа и
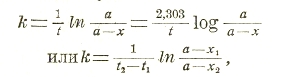
где Іn — логарифм при основании е, log — логарифм при основании 10, х1 — количество вещества, оставшееся неизмененным после t1 минут, а x2 — после 2 мин. Как пример мономолекулярных реакций можно привести превращение радиоактивных тел. О скорости их распада судят по изменению их радиоактивности (или способности производить ионизацию воздуха), которая со временем более или менее быстро падает; так, для тория Х она уменьшается через 4 дня до половины первоначальной величины, через 8 до 1/4, через 12 до 1/8 и т. д. Это можно выразить уравнением: It/I0 = l-λt
где I0 — активность в начале опыта,
It — таковая по истечении времени t,
λ — постоянная величина, характерная для тела и тождественная с константой скорости k. Величина λ показывает процент атомов какого-либо радиоактивного вещества, распавшихся в одну секунду времени.
Бимолекулярные реакции. В том случае, если в реакции участвуют два тела, скорость реакции, согласно закону действия, будет пропорциональна произведению из масс действующих тел, что может быть выражено уравнением:
![]()
где a — число молей одного тела (А), б — число молей другого (В) в начале реакции, а x — число молей, прореагировавших в течение времени. В том случае, если а = b, т. е. оба тела взяты в эквивалентных количествах, интегрирование приводит к следующему уравнению:
![]()
Если для реакции взяты не эквивалентные количества, то интегрирование дает следующее выражение:
![]()
Опытами над омылением уксуснокислого эфира и другими предыдущие уравнения были проверены.
Бимолекулярные реакции, рассматриваемые как мономолекулярные. В том случае, когда количество одного из реагирующих тел сравнительно с количеством другого так велико, что убывание его во время реакции является практически незаметным, то скорость реакции может быть вычислена по уравнению для мономолекулярных реакций. Возьмем вышеприведенный пример инверсии сахара: хотя в реакции участвуют два тела: сахар и вода, но последняя находится в таком количестве, что практически остается постоянной, и если в уравнении
![]()
b обозначает число молей воды, находящейся сравнительно с сахаром в большом избытке, то выражение (b — х) остается постоянным, и константа скорости к вычисляется по уравнению для мономолекулярных реакций. Опыт вполне подтверждает это.
Три - и полимолекулярные реакции. Из вышесказанного ясно, что в том случае, если в реакции участвуют n молекул, скорость реакции вычисляется по уравнению
![]()
где а, b, с...m —начальные концентрации реагирующих тел. Если а = b = c = m, то получаем:
![]()
Интегрируя это уравнение, нетрудно получить соответствующее выражение для k. Но нужно сказать, что, согласно кинетической теории, вероятность одновременной встречи многих молекул, участвующих в данной реакции, в одной точке очень мала и этим исключается возможность полимолекулярных реакций. Поэтому уравнения реакций, в которых участвуют как бы большое число молекул, представляют сумму уравнений реакций более простых (моно- и бимолекулярных), идущих последовательно одна за другой.
Влияние температуры на скорость реакций очень значительно. Например, по исследованиям Гаркура и Ессона константа скорости разложения перекиси водорода йодистоводородной кислотой: Н2О2 + 2HJ = J + 2Н2О, изменяется следующим образом:
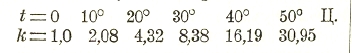
По Вант-Гоффу, повышение температуры на 10° влечет увеличение константы в два-три раза.
Бертло предложил следующую формулу для выражения зависимости скорости от температуры: К = а.b, Аррениус K=lA/T, гдe а, b, А — постоянные величины.
Влияние давления на скорость реакции в газах находится в зависимости от порядка реакции: если n молекул участвуют в реакции, то скорость превращения возрастает пропорционально (n—1)-ой степени давления. Отсюда, если реакция мономолекулярна (n = 1), скорость не меняется с давлением.
При бимолекулярной реакции (n=2) скорость превращения пропорциональна давлению. Этот вывод приблизительно подтверждается опытами Боденштейна над скоростью разложения йодистого водорода. Так, при 518°,
![]()
Влияние давления на скорость реакции в жидкостях можно было подметить только при повышении давления на несколько атмосфер. Согласно наблюдения Ротмунда, скорость инверсии 20%-го раствора сахара при действии нормального раствора соляной кислоты увеличивается приблизительно на 1%. при возрастании давления на 100 атмосфер.
Так, при 18° р = 1 К = 0,001337
15° p = 500 К = 0,001416.
Библиография: W. Ostwald. «Grundriss der allgemeinen Chemie». I изд. 1891, 4-ое издание сов. перераб. 1909. Первый русский перевод под ред. И. А. Каблукова, Москва, 1891, посл. с 4-го, под ред. П. И. фон-Веймарна, 1911. W. Nernst. «Theoretische Chemie». І-ое изд. 1893, последнее 1925. XV. С. Mс С. Lewis. «А system of Physical Chemistry. In three volumes»: Third edition. I. Kinetict theory. II. Thermodynamycs. III. Quantum Theory. 1924. ІІІ-я ч. в пер. изд. переведена на русский язык. Джонс. «Основы физической химии» Спб. 1911,. пер. Е. В. Бирона, И. И. Жукова и профессора А. В. Сапожникова. Джемс Уокер. «Введение в физическую химию» пер. Я. И. Мосешвили, 1915. Более новое издание пер. Н. А. Шилова. Тимофеев. «Физическая химия» И. А. Каблуков. «Основные начала физической химии» 3 вып. I. втор. изд. 1912. II. перв. изд. 1902, втор. 1922. III. —1910. В. А. Плотников. «Введение в изучение физической химии» Van't Hoff. «Acht Vorträge über Physikalische Chemie». 1902. Pycский перевод под ред. П. И. Вальдена. Рига, 1903. Van't Hoff. «Vorlesungen über theoretische und Physik. Chemie». 3 ч. 1898—1900. Van't Hof' «Химическое равновесие». Перевод под ред. А. Н. Щукарева. Svante-Arrhenius. «Theorien der Chemie nach Vorlesungen gehalten an der Universität von Kalifornien zu Berkley». Leipzig. 1906. Второе изд. 1909. Русский пер. Д. Д. Гарднера. СПБ. 1907.
Ив. Каблуков.
| Номер тома | 45 (часть 2) |
| Номер (-а) страницы | 325 |
