Имиды
Имиды. Так называются продукты замещения в аммиаке двух атомов водорода двухатомным (двухвалентным) остатком кислот. Как известно, частица аммиака может быть разделена: 1) на амид NH2 и атом водорода и 2) на имид NH и два атома водорода. В свободном состоянии, как амид, так и имид не могут существовать, но, согласно закону замещения, они могут замещать: амид один атом водорода, а имид — два. Хотя имид NH в свободном состоянии не получен, но, по Менделееву, его хлористоводородная соль NHHCl получена при накаливании двойной соли двухлористой платины и нашатыря: PtCl2NH4Cl = Pt + 2НСl + NHHCl. Она растворима в воде, из раствора кристаллизуется в шестигранных ромбических призмах.
Если группой NH2 заместить в одноосновной кислоте, например, уксусной, гидроксил, то получается амид кислоты, например, ацетамид — CH3.СO.NH2. Имиды же кислот получаются через замещения группой NH двух гидроксилов в двух- и многоосновных кислотах. Получаются они обыкновенно при нагревании кислых аммониевых солей двухосновных кислот, причем происходит выделение двух частиц воды:
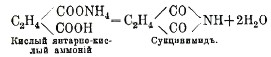
Для щавелевой кислоты С2Н2О4 известен также оксимид
![]()
, получающийся при действии пятихлористого фосфора на оксаминовую кислоту, или кислый амид щавелевой кислоты, С2О2(NH2)(ОН). Из двухосновных кислот способны образовать имиды только те, которые, выделяя частицу воды, легко образуют внутренние ангидриды.
Имиды представляют твердые кристаллические тела, легко растворимые в воде. При нагревании с водными растворами щелочей и кислот, легко присоединяют воду, разлагаясь при этом на аммиак и соответствующие кислоты или соли:
С2Н4(СО)2NH + 2Н2О = С2Н4(СООН)2 + NH3.
И. Каб.
| Номер тома | 21 |
| Номер (-а) страницы | 545 |
