Кетоны и их производные
Кетоны и их производные — кетозы, кетолы, кетонокислоты, кетоносиирты, — см. приложение.
Кетоны, обширный класс органических соединений, характеризующихся, подобно альдегидам, присутствием карбонильной группы![]()
В кетонах группа эта непосредственно связала с двумя углеродными атомами, тогда как в альдегидах, одна из свободных единиц сродства углерода карбонильной группы насыщается каким-либо органическим радикалом, другая же — водородом. Общие формулы для этих соединений поэтому таковы:
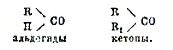
Радикалы R и R2, связанные с карбонилом, могут быть или независимы друг от друга (кетоны с открытий цепью), или же при участии карбонильной группы могут образовать замкнутую цепь (циклические кетоны). К первой группе кетонов относятся: 1) кетоны жирного ряда, предельные и непредельные: таковы, например, дикетилкетон (ацетон) CH3.CO.CH3, метилэтилкетон СН3.СО.С3Н5, этилиденацетон CH3.CH:CH.CO.CH2 и т. п. 2) кетоны жирноароматнческие, например, метилфенолкетон (ацетофенон) CH3.CO.C6H5. 3) кетоны ароматические, например, дифенилкетон (бензофенол) C6H5.СО.С6Н5, и т. д. Из этих примеров видно, что радикалы R и R2 связанные с карбонилом, могут быть одинаковы (простые кетоны) и различны (смешанные кетоны). Циклические кетоны в свою очередь бывают двух родов: 1) алициклические, в которых замкнутая цепь состоит лишь из одних углеродных атомов, и 2) гетероциклические, если в образовании цикла принимают участие, кроме углерода, также и другие атомы, например кислород, азот; они являются, таким образом, ближайшими производными пиррола, пиридина, пиразола и других простейших гетероциклических соединений. В природе кетоны встречаются довольно часто, но обыкновенно в незначительных количествах. Так, например, простейший кетон, ацетон, входит в состав нормальной лошадиной мочи (2,3—4 мг на 1 литр); он встречается также в моче человека, но лишь в тяжелых патологических случаях (Diabetes mellitus). В растительном царстве кетоны встречаются в разнообразнейших эфирных маслах и добываются из них в весьма значительных количествах для медицинских и парфюмерных целей. Сюда относятся некоторые кетоны жирного ряда (например, метил-гептил-кетон СН3.СО.С7Н15, метилгептенон СН3.СО.С5Н11 и др.) и особенно алициклические кетоны (мевтон, нулегон, карвон, камфара и т. д.). Все остальные соединения этого класса могут быть получены лишь синтетическим путем. Из общих методов получения кетонов важнейший — сухая перегонка кальциевых солей карбоновых кислот. Этим способом, например, пользуются в технике при получении ацетона из сырого уксусно-кислого кальция (см. ацетон).
Большое значение имеет метод сухой перегонки кальциевых солей для получения других кетонов, как простых, так и смешанных. В последнем случае берется смесь кальциевых солей уксусной и какой-либо иной одноосновной карболовой кислоты. Так, например, при перегонке смеси солей уксусной и бензойной кислот кроме простых кетонов ацетона и бензофенона, получается также смешанный кетон, ацетофенон:
![]()
Наконец, при сухой перегонке кальциевых солей некоторых двуосновных кислот получаются алициклические кетоны, например:
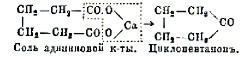
Еще более общее значение имеет другой метод получения кетонов, а именно окисление вторичных спиртов (обыкновенно хромовой кислотой). Так, например, при окислении пропилового спирта, CH3.CH(OH)CH3, получается ацетон, при окислении ментола – ментон, и т. д. Практическая применимость этой реакции однако значительно уменьшается вследствие малодоступности вторичных спиртов, которые сами обыкновенно получаются из кетонов.
Кроме этих двух способов получения кетонов, существует немало других, не имеющих однако, столь общего значения. Для получения, например, ароматических и жирноароматических кетонов обыкновению действуют на ароматический углеводород хлорангидридом той или иной кислоты в присутствии безводного хлористого алюминия. Образуется сложное соединение, содержащее алюминий, которое при разложении водой дает соответствующий кетон. Так, например:
![]()
Кроме ароматических углеводородов реакция эта применима также к углеводородам непредельным и алициклическим. Кетоны образуются далее при разложении водой продуктов взаимодействия металлорганических соединений с хлорангидридами, а также с нитрилами кислот. Наконец, кетоны получаются при расщеплении ацето-уксусного эфира и его производных (см. кетонокислоты).
Общие свойства кетонов обусловливаются наличностью карбонильной группы с ясно выраженным ненасыщенным характером, вследствие чего все кетоны обнаруживают, прежде всего, реакции присоединения. При действии водорода, в момент выделения кетоны присоединяют по месту карбонильной группы два атома водорода и переходят во вторичные спирты. Так, например:
![]()
Безводная синильная кислота, HCN, присоединяется к кетонам с образованием так называемых оксицитрилов:
![]()
С металлорганическими соединениями кетоны образуют продукты присоединения, при разложении водой дающие третичные спирты, например из ацетона — триметил-карбинол; (CH3)2CO + CH3MgBr = (CH3)3COMgBr:(CH3).COMgBr + H2O (CH2)3C.OH. Наконец, и целый сернисто-кислый натрий также присоединяется ко многим кетонам, при этом образуются так называемые бисульфитами соединения, имеющие большое значение для очистки кетонов от примесей. При целом ряде других реакций кетонов в первой фазе, вероятно, также происходит присоединение по месту карбонильной группы. Однако, получающиеся при этом вещества могут оказаться настолько неустойчивыми, что по мере образования тотчас же происходит их распад в новом направлении. Конечными продуктами таких реакций являются соединения, которые можно вывести из кетонов путем замещения карбонильного кислорода на ту или иную группу атомов. Так, например, при действии пятихлористого фосфора на кетоны получаются дихлориды: (CH3)2CO + PCl2 = (CH3)2.CCl2 + POCl3; при действии гидроксинамина NH2OH, получаются оксимы: (CH3)2CO + NH2OH = (CH3)2.C = NOH + H2O; с фенилгидразином обрадуются гидразины: (CH3)2CO + H2N.NHC6H5 = (CH2)3C = N.NHC6H5. Эти реакции особенно важны, так как оксимы и гидразины многих кетонов представляют из себя характерные кристаллические вещества, легко получаемые в чистом виде; при взаимодействии их с разбавленными кислотами получаются обратно кетоны. Слабые окислители вовсе не действуют на кетоны, сильные же вызывают распад частиц, приводят к образованию карбоновых кислот с меньшим числом атомов углерода, чем было у исходного вещества. Исключение составляют алициклические кетоны, у которых рядом с карбонилом находится группа CH2. Главным продуктом окисления таких алициклических систем являются двуосновные кислоты с тем же числом атомов углерода в частице. Их групповые отличия обуславливаются характером радикалов, связанных с карбонильной группой. В общих чертах радикалы эти в кетонах сохраняют те же свойства, что и в других классах органических соединений. А именно в предельных кетонах они способны лишь к реакциям замещения; так, например, ацетон при действии хлора дает хлорацетон, СН3 СО . СН2 Сl, и т. д.; в непредельных кетонах эти радикалы обнаруживают склонность к реакциям присоединения; ароматические радикалы (С5Н6 и др.) сохраняют и здесь способность легко вступить во взаимодействие с азотной и серной кислотами, давая соответствующие нитросоединения и сульфокислоты, и т. д.
В пределах подобных групп наблюдаются еще индивидуальные отличия отдельных представителей, зависящие от атомного веса и строения радикалов, связанных с карбонилом. Факторы эти оказывают влияние главным образом на физические свойства отдельных индивидуумов; однако различие в строении радикалов вызывает иногда довольно существенное различие в отношении к тому или иному реагенту.
Кетозы, особая группа кетоно-спиртов (гм. кетолы), в которых на одну карбонильную группу приходится два, три и более гидроксилов, распределенных но одному у атомов углерода цепи. Вместе с соответствующими альдегидоспиртами, альдозами, кетоны составляют группу простейших углеводов, так называемых моносахаридов (см. глюкозы). Общий способ получения кетонов — окисление соответствующих многоатомных спиртов, причем обыкновенно образуются и соответствующие альдозы. В чистом виде кетоны получаются при этой реакции, если окисление идет под влиянием особого вида аэробной бактерии — Bacterium xylinum. Этим путем при окислении, например, глицерина, HOCH2.CHOH.CH2OH получается диоксиацетон, HOCH2.CO.CH2OH, из сорбита получается сорбоза, из маннита — фруктоза, и т. д. По своим свойствам кетоны представляют из себя типичные α-кетолы (сл.).
Кетолы (кетоно-спирты, оксикетоны), класс органических соединений двойственной функции, проявляют, одновременно свойства кетонов и спиртов, вследствие чего строение их характеризуется одновременным присутствием двух групп: кетонной >СО и сииртовой —ОН. По относительному положению этих двух групп различают: α (или 1,2), β (или 1,3), γ (или 1,4)-кетоны и т. д. Важнейшие из них α-кетоны, т. о. такие кетоно-спирты, у которых карбонильная и гидроксильная группы находятся при соседних углеродах. Таков, например, простейший α-кетон — ацетон (оксиацетон) CH3.CO.CH2(OH). Получаются кетоны или осторожным восстановлением α-дикетонов, или же из α-галоидозамещенных кетонов; так, например, при действии уксуснокислого калия на хлорацетон образуется уксусный эфир ацетона, из которого омылением получают и самый кетон. Из химических свойств α-кетонов следует указать прежде всего на их способность окисляться под влиянием даже самых слабых окислителей (щелочного раствора окиси меди, аммиачного раствора серебра и т. п.). Этой характерной особенностью α-кетонов объясняется также их взаимодействие с фенилгидразином. Как кетоны, они дают с этим реактивом сначала гидразон; затем фенилгидразон действует, как окислитель, превращая гидразон в озазон. Как спирты, кетоны образуют эфиры сложные и простые. Особую группу кетонов представляют кетозы (см.).
Кетонокислоты, класс органических соединений двойственной функции, проявляющих свойства кетонов и кислот, вследствие этого в их структурных формулах предполагают одновременное присутствие >СО и —СООН. По относительному положению этих характерных групп различают α-(или 1,2), β-(или 1, 3), γ-(или 1,4)-кетоны и т. д. Простейшие представители этих групп: пировиноградная СH3.СО.СООН (α-кетоны); ацетоуксусная СН3.СО.СH2.СООН (β-кетоны); левулиновая СН3.СО.СH2.СH2.СООН (γ-кетоны). Для получения кетонов применяются особые методы: α-кетоны получаются действием цианистого калия на хлорангидриды одноосновных кислот с последующим омылением образующегося нитрила, чем вполне выясняется строение этих кетонов; β-кетоны в свободном состоянии получаются омылением своих сложных эфиров, имеющих весьма важное значение. Простейший из них, ацетоуксусный эфир, получается конденсацией двух частиц уксусного эфира под влиянием этилата натрия. Наконец, γ-кетоны могут быть получены различными реакциями; простейшая из них — комбинация ацетоуксусного эфира с эфирами α-галоидозамещенных кислот в присутствии алкоголита и омыление получающегося дикарбонового эфира, сопровождаемое его «кетонным расщеплением». Как кислоты, кетоны образуют соли и сложные эфиры; как кетоны, они вступают во взаимодействие с гидроксиламином и фенилгидразином. Различия между отдельными группами кетонов заключаются прежде всего в различной прочности их представителей. β-кетоны отличаются следующими особенностями: тогда как α и γ-кетоны перегоняются в вакууме (простейшие даже при обыкновенном давлении) без разложения, β-кетоны разлагаются уже при температурах ниже 100°. В зависимости от условий этот распад может пойти в двух направлениях, например, при омылении ацетоуксусного эфира разбавленными кислотами происходит выделение углекислоты, спирта и ацетона («кетонное расщепление» ацетоуксусного эфира). Если же действовать на этот эфир крепкой щелочью, то реакция идет с образованием двух частиц уксусной кислоты в виде ее соли («кислотное расщепление»). Взаимодействие β-кетонов и их эфиров с гидроксиламином и фенилгидразином не ограничивается образованием соответствующих оксимов и гидразонов, как эго бывает с представителями двух других групп кетонов, а идет дальше, и приводит к образованию гетероциклических соединений, имеющих важное техническое значение. Так, например, ацетоуксусный эфир с фенилгидразином дает фенилметилпиразолон, который находит применение для получения антипирина. Водороды группы CH2, находящейся между карбонилом и карбоксилом, способны замещаться на металл. Реакция эта сопровождается внутренней перегруппировкой и, например, с металлическим натрием или его алкоголятом приводит к образованию так называемого натранетоуксусного эфира. Вещество это легко вступает во взаимодействие с галоидами и самыми разнообразными галоидозамещенными органическими соединениями, причем получаются эфиры замещенных β-кетонов, которые можно подвергнуть кетонному или кислотному расщеплению (ср. выше). Эфиры β-кетонов, способны реагировать в виде двух таутомерных модификаций: кетонной и энольной (спиртовой). Для ацетоуксусного эфира эти модификации выражаются следующими формулами:
Новейшие наследования показали, что обыкновенный ацетоуксусный эфир (бесцветная жидкость с температурой кипения 79° при 18 mm, застывающая при —43°—45°) действительно представляет из себя смесь двух изомеров. Один из них, — жидкий, получается действием сухого хлористоводородного газа на натрац.-уксусный эфир, взвешенный в петролейном эфире; этот изомер не застывает в смеси эфира и твердой углекислоты и почти тотчас дает фиолетовое окрашивание с хлорным железом. Как натрац.-уксусному эфиру, так и получаемой из него жидкой модификации самого эфира придают энольную формулу. Другой изомер ацето-уксусного эфира выделяется в иглах (температура плавления — 39°) при охлаждении смесью эфира и твердой углекислоты растворов обыкновенного ацетоуксусного эфира в алкоголе или гексане. Эта модификация не дает окрашивания с хлорным железом; ей приписывают другую, кетонную, формулу. Оба изомера ацетоуксусного эфира, довольно устойчивые при очень низких температурах, в обыкновенных условиях быстро превращаются друг в друга, причем между обеими модификациями образуется равновесие. «Обыкновенный» ацетоуксусный эфир содержит 90% кетоформы и из больше 10% энольной формы.
С. Наметкинг.
| Номер тома | 24 |
| Номер (-а) страницы | 101 |
