Металлография
Металлография (греческий) — учение о металлах и их сплавах. Как современная наука, металлография изучает строение, физические, химические и технические свойства металлов и их сплавов, пользуясь для этого главным образом микроскопом и пирометром. Впервые микроскоп для изучения строения металлов был применен англичанином Н. Sorby (1863 г.). Первые микрофотографии металлов даны Osmond'oм в 1882 г. Пирометр был изобретен Le Chatelier в 1886 г. В России первые исследования по изучению строения стали принадлежат профессору Чернову (1868 г.). Лишь в конце XIX в. металлография сделалась предметом изучения выдающихся ученых всех цивилизованных стран, а в настоящее время она излагается, как отдельный предмет, в стенах специальных учебных заведений; и почти все крупные заграничные и русские металлические заводы имеют отдельные металлографические лаборатории.
Сопоставляя зависимость физических свойств сплавов с их химическим составом и микроскопическим строением, металлография дает металлургу возможность идти в деле получения сплавов чисто научным, а не эмпирическим путем.
Наиболее широкое применение металлография имеет в деле получения железных и антифрикционных сплавов.
Основы металлографии. Большинство сплавов не представляет только механическую смесь.
Элементы, их составляющие дают частью химические соединения, частью твердые растворы, которые образуют в сплаве тесную смесь, подобную граниту. Составляющие сплава имеют крайне незначительную величину и могут быть обнаружены лишь при помощи микроскопа. Трудность изолирования отдельных составляющих сплава не позволяет непосредственно изучать их химический состав и заставляет идти путем обходным. Изучение температуры и условий затвердевания, при которых в сплаве происходят химические изменения, дает возможность с большей или меньшей вероятностью судить о взаимоотношении и составе образующих сплава. Процесс отвердевания и охлаждения сплава характеризуется остановками в падении температуры (критические точки). Критические точки соответствуют химическому или физическому изменению тела. При охлаждении тела в нем могут происходить лишь изменения, сопровождающиеся выделением тепла, — чем и объясняются остановки в падении температуры.
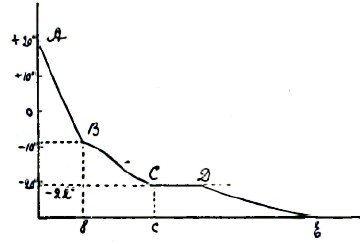
Рис.1.
Простейший пример, характеризующий значение критических точек, представляет процесс охлаждения и затвердевания растворов поваренной соли. Графически процесс охлаждения и затвердевания 10-ти % раствора поваренной соли изображен на рис. 1, где по оси координат отложены температуры, а по оси абсцисс — время; линия АВ выражает зависимость между временем и температурой. Для раствора указанной концентрации до —8° падение температуры идет равномерно и беспрепятственно. В точке Б падение температуры на некоторое время замедляется, что соответствует замерзанию части воды и повышению концентрации жидкого раствора. Эта концентрация продолжается в течение промежутка времени bс, при соответственном падении температуры до —22°. При температуре —22° застывает весь оставшийся раствор при значительной остановке в падении температуры. Ниже —22° охлаждение совершается равномерно по линии DE; таким образом, процесс охлаждения и затвердевания раствора поваренной соли сопровождается двумя остановками в падении температуры. Процесс охлаждения и затвердевания раствора NaCl любой концентрации изображен на рис. 2, где по оси абсцисс отложены % концентрации NaCl в растворе, а по оси ординат —температуры.
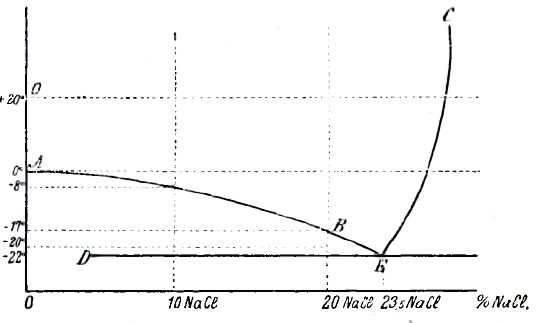
Рис. 2.
Рассмотрим для примера по рис. 2 процесс затвердевания 20% раствора NaCl. Выше линии АЕ раствор охлаждается без выделения твердой фазы. Например, для 20% раствора в точке В, соответствующей —17°, начинается выделение кристаллов воды (льда) и соответствующее этому повышение концентрации оставшейся жидкой фазы, возрастающей до 23,5% NaCl по линии ВЕ, т. е. при продолжающемся охлаждении до —22°. При —22° наблюдается продолжительная остановка в падении температуры, и весь раствор затвердевает. Дальнейшее охлаждение совершается равномерно, без остановок в падении температуры. Рассматривая по рис. 2 процесс затвердевания 23,5% раствора NaCl, находим, что до —22° раствор означенной концентрации охлаждается без остановок в падении температуры, а, следовательно, и без выделения какой-либо твердой фазы. При —22° весь раствор затвердевает при постоянной температуре. При затвердевании растворов, лежащих правее точки Е, т. е. с концентрацией выше 23,5%, по линии СЕ выделяются кристаллы NaCl, за счет чего концентрация оставшегося раствора понижается до 23,5%, который и затвердевает при —22°. Итак, при охлаждении любого раствора соли, лежащего левее точки Е, происходят следующие явления: раствор, охлаждаясь, при определенной температуре, соответствующей его концентрации и определяемой кривой АЕ, начинает выделять кристаллы чистой воды. Это выделение кристаллов льда сопровождается остановкой в падении температуры и увеличением концентрации оставшейся жидкой части до 23,5%, которая и затвердевает при постоянной температуре в —22°.
Раствор, соответствующий точке Е, т. е. содержащий 23,5%, равномерно охлаждаясь до —22°, весь затвердевает при этой температуре. Все растворы левее точки К, охлаждаясь но линии СЕ, выделяют кристаллы NaCl и окончательно затвердевают опять при —22°. Согласно этому затвердевший раствор поваренной соли, в зависимости от своего положения левее или правее точки Е, будет состоять в первом случае из кристаллов льда + застывший при —22° 23,5% раствор NaCl, а во втором случае — из кристаллов NaCl + тот же 23,5% раствор NaCl и, наконец, раствор соли, соответствующий точке Е ниже —22°, будет представлять тот же затвердевший 23,5 раствор NaCl. Что же представляет по своему строению затвердивший раствор 23,5% NaCl в воде? По исследованию Ofier'а и Ponsot’а оказывается, что этот затвердевший раствор не представляет однородной массы, а состоит из тесно перемешанных кристаллов льда и кристаллов соли. Такая тесная смесь, образованная окончательным одновременным затвердеванием раствора, названа эвтектической (эта смесь затвердевает последней).
Все растворы NaCl в воде, содержащие от 0 и до 23,5% NаCl, при затвердевании будут состоять из кристаллов льда, окруженных эвтектикой. Затвердевший 23,5% раствор NaCl состоит лишь из эвтектики, и, наконец, растворы, содержащие более 23,5% NaCl, в твердом виде состоят из кристаллов NaCl, окруженных эвтектикой.
Процессы охлаждения и затвердевания металлических сплавов представляют те же характерные явления, как и процесс затвердевания поваренной соли в водном растворе.
Из жидкого сплава двух металлов при некоторой определенной температуре, в зависимости от % содержания образующих его элементов, выделяются сперва кристаллы одного из лих. Это выделение сопровождается остановкой в падении температуры и обогащением жидкой фазы противоположным элементом. Процесс этот совершается до тех пор, пока не будет достигнуто известное % соотношение элементов жидкой фазы, вполне определенное для каждой пары, составляющей сплав. Соотношение это именуется эвтектическим, в котором элементы и затвердевают при постоянной температуре, образуя эвтектику. Но процесс затвердевания сплавов протекает не всегда так просто. Способность составляющих сплав элементов образовывать твердые растворы и давать одно или несколько химических соединений, дающих самостоятельные эвтектики, сильно усложняет картину затвердевания, которая может быть изображена подчас лишь очень сложной диаграммой. Для сплавов характерным является то обстоятельство, что и после окончательного отвердевания всех составных частей его в нем происходят часто процессы с образованием новых составляющих сплава, а также и эвтектических смесей (твердые растворы), как это и наблюдается, например, при охлаждении и затвердевании железных сплавов. При охлаждении тройных сплавов совершаются те же процессы, но диаграмма охлаждения и затвердевания не укладывается в плоскости, но легко может быть построена на трех пересекающихся взаимно перпендикулярных плоскостях.
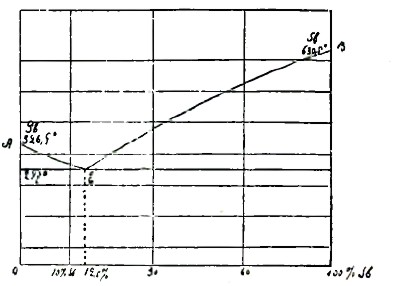
Рис. 3.
Порядок застывания тройного сплава следующий: сперва выкристаллизовывается один из металлов, затем образуется двойная эвтектика, в состав которой входят элемент, выделившийся первым, и один из оставшихся, и, наконец, образуется и затвердевает тройная эвтектика, в состав которой входят все три элемента, образующие сплав. Кривая охлаждения тройных сплавов должна иметь не менее 3 остановок. Под микроскопом на тройных сплавах удается обнаружить кристаллы одного элемента, окруженные двойной и тройной эвтектикой. Если тройные сплавы образуют твердые растворы и химические соединения, то структура и диаграммы их сально усложняются.
Пример металлических сплавов, не образующих ни твердых растворов, ни химических соединений, имеем в сплаве свинца и сурьмы, затвердевание которых изображено на рис. 3.
Диаграмма затвердевания сплава свинца и сурьмы ничем не отличается от диаграммы затвердевания раствора поваренной соли. 87,5% свинца и 12,5% сурьмы образуют эвтектику, затвердевающую при температуре 247°. Сплавы, содержащие свинца более 87%, затвердевают, выделяя сперва по линии АЕ кристаллы свинца и образуя, наконец, эвтектику указанного выше состава. Сплавы, более богатые сурьмой, выделяют по линии ЕВ кристаллы сурьмы и при охлаждении до 228° дают опять ту же эвтектику.
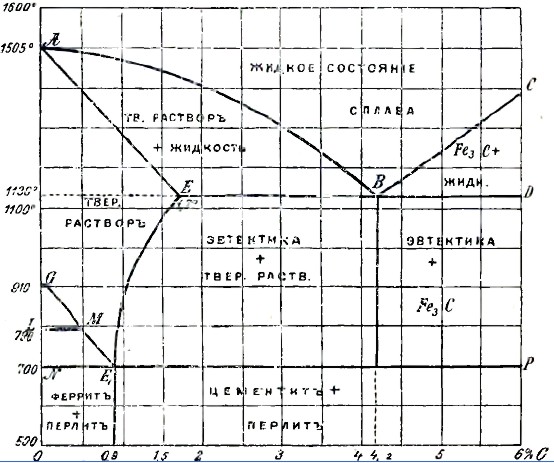
Рис. 4.
Как образец сплава, дающего твердые растворы и химические соединения, может служить очень распространенный сплав углерода с железом: сталь и чугун. Изучение сплавов железа и углерода началось еще с 1871 г., но только в настоящее время их строение и диаграммы можно считать разработанными с достаточной полнотой и ясностью. Первое в достаточной мере полное представление о сплавах железа и углерода было дано Робертсом Аустеном в 1899 г. Затем в последнее десятилетие в диаграмму Робертса Аустена были внесены существенные поправки, и, наконец, в самое последнее время группа исследователей (Wust, Goerens, Гутовский) выработала ясную, простую и в то же время вполне исчерпывающую вопрос диаграмму для всех сплавов железа с углеродом, изображенную на рис. 4.
Из рисунка 4, в котором по оси ординат отложены температуры, а по оси абсцисс — % содержания углерода в железном сплаве, видно, что начало затвердевания сплава меняется в зависимости от % содержания в нем углерода (С).
Чистое железо (Fe) затвердевает при 1505°, сплав с 4,2% С — при «30°, сплав с 6%С — около 1400°. Таким образом, линия АВС отделяет жидкое состояние сплава от твердого вещества. Рядом исследований доказано, что в расплавленном состоянии железо, содержащее углерод, содержит этот последний в виде химического соединения Fe3С (карбида).
Карбид растворяется в чистом железе и понижает его точку затвердевания. Растворимость Fe3С в железе падает с понижением температуры. Способность Fe растворять Fe3С не исчезает и при эатвердевании. Твердый раствор Fe3С в железе бывает переменного процентного соотношения, но содержит всегда не более 1,7% что соответствует температуре «30°. С понижением температуры способность твердого Fe растворять Fe3C также понижается. Твердый раствор Fe3С в Fe получил название аустенита. На основании вышесказанного видно, что при затвердевании сплава железа с углеродом приходится иметь дело с системой Fe и Fe3С.
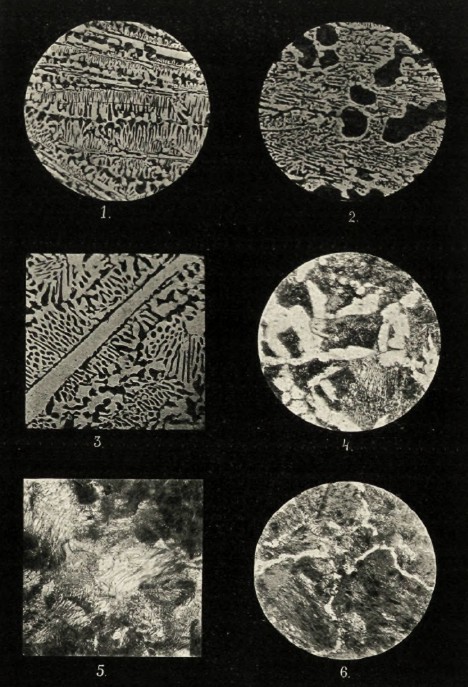
Подобно процессу затвердевания раствора поваренной соли и сплава свинца и сурьмы, при затвердевании и охлаждении системы Fe и Fe3С возможны три случая: 1) процентное соотношение Fe и Fe3C будет доэвтектическое, 2) эвтектическое и 3) сверхэвтектическое. В первом случае процесс затвердевания пойдет с выделением кристаллов аустенита — это выделение совершается по линии АВ для всех сплавов, содержащих С менее 4,2%, так как эта цифра соответствует эвтектике. Процентный состав выделяющегося аустенита при каждой определенной температуре определяется линией АЕ. За счет выделения аустенита жидкая фаза обогатится С до эвтектического соотношения и затвердеет по линии ЕВ. Под микроскопом такой материал будет состоять из кристаллов аустенита, окруженных эвтектикой, как это и видно на микрофотографии № 2 (темное — кристаллы аустенита, светлое — эвтектика). Сплав с содержанием 4,2%С затвердевает весь одновременно в точке В, образуя эвтектику, представляющую тесную смесь твердого раствора С в Fe (аустенита) и карбида, как это и видно на микрофотографии № 1. Сплавы с большим содержанием С начинают затвердевать по линии СВ, выделяя избыточный карбид и затвердевая окончательно по линии ED. Под микроскопом, как и надо ожидать, они состоят из выделившегося вперед цементита (карбида), окруженного эвтектикой, как это и видно на микрофотографии № 3 (белая полоса — цементит, остальное — эвтектика). Ниже линии ED, т. е. ниже температуры «30°, все железные сплавы находятся в твердом состоянии, но благодаря тому, что способность Fe растворять С или Fe3С падает с понижением температуры, — охлаждающиеся сплавы претерпевают еще ряд изменений. При температуре «30° железо удерживает 1,7%С (точка Е), почему все сплавы с содержанием С ниже этой цифры затвердевают без образования вышеуказанной эвтектики и в момент своего затвердевания состоят лишь из одного аустенита. При охлаждении твердого сплава выше этой температуры из него начинает выделяться С в той форме, в которой он находился в растворе, т. е. в виде Fe3С. На рисунке этому процессу соответствует линия ЕЕ1. Выделение Fe3С совершается до тех пор, пока температура сплава не упадет до 700°, при которой железо еще способно растворять 0,9% С. Ниже 700° способность железа растворять С резко понижается почти до 0%, почему при указанной температуре происходит процесс, подобный эвтектическому, с образованием тесной смеси кристаллов железа и карбида. Смесь эту принято именовать перлитом. Таким образом, сплавы с содержанием С от 0,9 до 1,7% при обыкновенной температуре должны состоять из кристаллов цементита, окруженных эвтектикой (перлитом), что мы и видим на микрофотографии №6 (белое — выделившийся вперед цементит, остальное — перлит).
Сплавы с содержанием 0,9%С затвердевают около 1480° и до 700° состоят из одного аустенита, непосредственно ниже которой и видоизменяются с образованием эвтектики — перлита (феррит—цементит). Картину эвтектики дает микрофотография № 5. Бедные углеродом сплавы с содержанием последнего в пределах от 0 до 0,9% затвердевают по линии АВ и претерпевают уже в твердом состоянии еще некоторые изменения, состоящие в выделении по линии GE кристаллов чистого железа — феррита, что ведет к обогащению оставшегося аустенита углеродом в пределах до 0,9%. Аустенит при температуре 700° разлагается, как уже указывалось раньше, с образованием эвтектики — перлита.
На фотографии такие сплавы будут состоять из зерен феррита, окруженного перлитом, как это и видно на микрофотографии № 4.
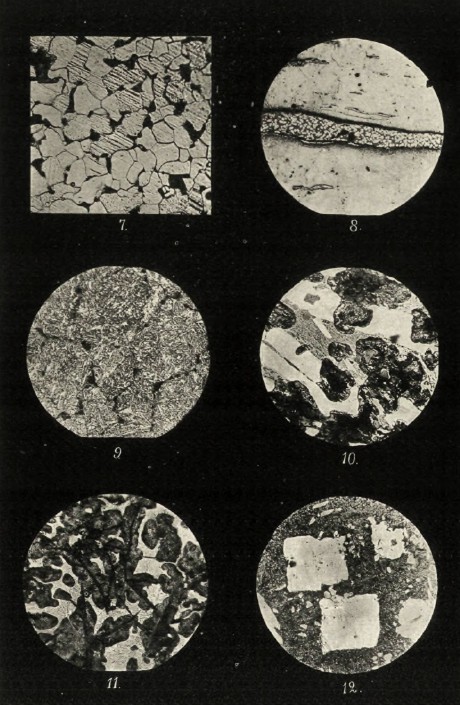
Наконец, линии GM и LM соответствуют перекристаллизации зерен железа с переходом его в γ, δ и α состояния. Таким образом, линия NE1Р диаграммы соответствует как бы эвтектическому перестроению твердых растворов углерода в железе — ниже ее и левее точки Е1 могут существовать лишь феррит и перлит, а ниже ее, но правее точки E1 — перлит и цементит. Перестроение вещества, соответствующее линии NP, совершается в твердом веществе. Получающаяся в этом случае эвтектика ничем, в сущности, не отличается от эвтектики затвердевания, но ввиду разности условий в образовании ей присвоено название эвтектоида. Согласно всему вышесказанному, сплавы железа и углерода при обыкновенной температуре могут содержать, как структурные элементы, лишь феррит, перлит и цементит, но на практике оказывается, что в зависимости от условий охлаждения и примесей других металлов или металлоидов в них могут оказаться и некоторые другие структурные элементы. Так, например, если обыкновенный чугун охлаждать очень медленно, в нем место цементита займет графит, как это и видно на микрофотографии № «. Появление графита объясняется тем, что при высокой температуре около 1000° свободный, т. е. не растворенный железом, карбид способен разлагаться с выделением свободного углерода (графита) и железа (феррита). При низких температурах разложение это совершается значительно труднее, почему, например, карбид перлита может разлагаться лишь в особых условиях (длительный отжиг); углерод в этом случае выделяется в мелко раздробленном состоянии (аморфный углерод, углерод отжига). Другой характерный пример изменения структуры в зависимости от условий охлаждения мы имеем в закаленных материалах. При быстром охлаждении раскаленной стали, достигаемом погружением ее в воду, в ней не успевают произойти явления, соответствующие диаграмме, и как бы фиксируется ее жидкое строение; углерод остается в виде карбида, растворенного в железе. Под микроскопом такой материал характеризуется особой структурой — мелкие пересекающиеся под углом в 60° иглы, именуемые мартенсит. Наряду с мартенситом выделяются иногда и продукты, свидетельствующие о начавшемся образовании перлита — сорбит, тростит. Структуру закаленного образца даст микрофотография № 9 (светлое — мартенсит, темное — включения троостита).
Встречающиеся в технике сплавы железа и углерода содержат всегда примеси других элементов (кремний, марганец, сера, фосфор). Все эти элементы более или менее растворимы в железе, образуя твердые растворы, но, несмотря на это, метод макроскопического исследования сплавов все же дает возможность судить о присутствии и количестве этих примесей, частью по форме и величине зерен феррита, а частью по присутствию их химических соединений: микрофотография № 7 даст нам структуру сравнительно мягкого железа с содержанием С в 0,16%, — несмотря на это, углерод, заключающийся в эвтектике, обнаруживается весьма легко (светлое — феррит, темное — эвтектика). На микрофотографии № 8 видна характерная структура сварочного (кричного) железа. Очень мягкий материал, почти не содержащий углерода, содержит в то же время значительные включения шлака (толстая поперечная полоса, пересекающая шлиф, — шлак, остальное — мягкое железо). На микрофотографии № 10, представляющей белый чугун, кроме главных составных частей — перлита и цементита, очень отчетливо видны фосфор и сера. Фосфор, образующий тройную эвтектику с Fe и С, заключается в серой точечной массе, идущей поперек всей микрофотографии. Сера в виде правильных кристалликов сернистого марганца, разбросанных по шлифу (счетом около 10 шт.). На снимке № « серого чугуна, кроме его главносоставляющих графита и перлита, еще очень отчетливо виден фосфор в виде двойной эвтектики (Fe, Ph) — большие белые пятна с массой точек и штрихов. Присутствие серы, содержащейся всего в количестве 0,07%. удается обнаружить лишь в виде двух маленьких кристаллов сернистого марганца.
Очень характерную структуру под микроскопом дают антифрикционные сплавы. Их строение позволяет с полной отчетливостью судить об их физических свойствах. Образец такого сплава баббита дает микрофотография № 12, на которой видны все составляющие сплава: олово, сурьма, медь. Сурьма, образуя с оловом химическое соединение SuSb, выделялась в виде больших правильной формы кристаллов; медь также в соединении с оловом Cu3Sn образовала целый ряд мелких кристаллов, расположенных как на основной массе, так и на кристаллах SnSb, и, наконец, вся основная масса шлифа представляет двойную эвтектику, образованную твердыми растворами олова и сурьмы.
Техника металлографии. Приготовление шлифов. Очень мелкая структура металлических сплавов требует для их изучения применения больших увеличений (300—1500 раз). Непрозрачность металлов не позволяет рассматривать их в проходящем свете и заставляет изучать в отраженном. Чтобы все точки рассматриваемого под микроскопом металла были ясно видны, необходимо поместить их в фокусе, а для этого нужно, чтобы изучаемая поверхность была плоской.
Для получения плоскости приготовляют шлифы. Приготовление шлифа состоит из грубой обделки поверхности на точильном камне, последовательной шлифовки все более и более тонкими сортами наждачной бумаги и полировки на сукне полировальными порошками (крокус, окись алюминия и др.). Полученная таким путем зеркальная поверхность изучается под микроскопом. Ввиду различной твердости составляющих сплава некоторые из них, более мягкие, вытираются глубже, твердые остаются в рельефе, давая т. о. структуру сплава.
По большей части для более полного проявления структуры шлиф подвергают еще процессу протравки. Протравка состоит в обработке изучаемой плоскости шлифа очень слабыми кислотами или некоторыми другими реактивами и обусловливается или очень слабым поверхностным разъеданием некоторых структурных элементов, или просто их окрашиванием.
Литература. Интерес к изучению металлических сплавов за последнее пятилетие возрос настолько, что, кроме отдельных статей этой области, заполняющих собой русские и иностранные химико-технические журналы, появились специальные металлографические периодические издания, как, например, «Internationale Zeitschrift für Metallographie», «MetalJorgie» и др. и целый ряд специальных сочинений, затрагивающих исключительно вопросы о сплавах, из которых должны быть отмечены: Behrens, Brannt, Buchetti, Gages, Goerens, Guillet, Gulliver, Guertler, Евангулов, Howe, Ledebur, Roberts Austen и др.
Ф. Герке.
Объяснение к таблицам
1. Эвтектический чугун (С—4,2%).
2. Доэвтектический чугун (С—3,9%).
3. Сверхэвтектический чугун (С—4,52%).
4. Доэвтектическая сталь (С—0,7%).
5. Эвтектическая сталь (С—0,9%).
6. Сверхэвтектическая сталь (С—1,07%).
7. Мягкое железо.
8. Кричное железо (со шлаком).
9. Закаленная сталь.
10. Белый чугун (С - 2,83; Ph —1,33: Мn - 0,54; Si - 0,27; S — 0,19).
«. Серый чугун (С — 3,94; Рb — 1,95; Мn — 1,58; Si — 0,57; S — 0,04).
12. Баббит (Su — 81; Sb - 12; Pb —2; Сu — 5%).
| Номер тома | 28 |
| Номер (-а) страницы | 528 |
