Органические кислоты
Органические кислоты.
Органические кислоты, карбоновые кислоты, обширный класс органических соединений, характеризующихся группой СООН (карбоксил), связанной с одновалентным радикалом R. Из отдельных представителей этого класса уксусная кислота в виде сырого винного уксуса была известна уже в глубокой древности. Другие кислоты, частью в свободном состоянии, частью в виде солей и сложных эфиров, были открыты гораздо позднее. Органические кислоты широко распространены в природе, главным образом в виде солей и сложных эфиров, особенно глицерина (жиры). Свободные кислоты могут быть отсюда легко получены: из солей простым действием минеральной кислоты, из сложных эфиров — их омылением. Они образуются далее при разнообразнейших процессах окисления органических веществ. При этом могут получаться кислоты с тем же числом атомов углерода в частице, что у исходного вещества, как это бывает, например, при окислении альдегидов, первичных спиртов и некоторых углеводородов, особенно ароматических. Чище однако происходят более или менее глубокий распад молекулы, в результате которого получается смесь нескольких низших кислот вплоть до углекислоты включительно. Из методов получения органических кислот с большим числом атомов углерода, чем было у исходного вещества, наиболее простым и в то же время общим является переход к органическим кислотам через нитрилы. Действием цианистого калия на то или иное галоидопроизводное получают сначала нитрил кислоты: RJ + КCN = RCN + KJ; затем его омыляют нагреванием с минеральной кислотой или щелочью:
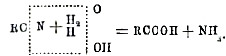
Другой, не менее общий синтез органических кислот, это — получение их при помощи металлоорганических соединений; так, например, на приготовленное заранее магний-органическое соединение действуют сухой углекислотой и разлагают затем водой образующееся комплексное соединение:
![]()
Наконец, громадное значение в органической химии имеют синтезы органической кислоты с помощью малонового (см.) и ацетоуксусного зопров (см. кетонокислоты, XXIV,99/100, приложение 3). В химических свойствах органических кислота, несмотря на все разнообразие соединений этого класса, наблюдается много общего; однако между отдельными группами органических кислот существует помимо также и групповых отличий. С точки зрения теории строения различия эти зависят от состава и характера радикала R, общие же свойства органических кислот обусловливаются наличностью карбоксильной группы, общей всем соединениям этого класса. Общая формула строения органических кислот:
![]()
Из ряда общих свойств соединений этого класса на первом месте следует поставить их более или менее резко выраженные кислотные свойства. В зависимости от характера радикала R, связанного с карбоксилом, мы встречаем здесь все градации, начиная с весьма слабых кислот, у которых даже щелочные соли гидролитически разлагаются, и кончая такими, которые по силе превосходят большинство минеральных кислот. Среди органических кислот есть кислоты одно-, двух-, трех- и вообще многоосновные. Основность органических кислот обусловливается числом карбоксилов в молекуле; при образовании солей именно водород карбоксильной группы (а не какой-либо из водородов радикала R) замещается на металл. Лишь в редких случаях такое замещение может быть произведено непосредственно действием металла на кислоту; обыкновенно для получения солей на органические кислоты действуют окислами металлов, их гидратами и углекислыми солями, или, наконец, если соль трудно растворима, ее получают обменным разложением какой-либо легко растворимой соли того же металла со щелочной или аммонийной солью органических кислот. Нейтрализация уксусной кислоты, например, едким натром, может быть выражена следующим уравнением:
CH3.COOH + NaOH = CH3COONa = H2O
Совершенно аналогично этой реакции происходит взаимодействие органической кислоты со спиртами, причем вместо соли образуется сложный эфир органической кислоты:
R.COOH + C2H5OH = R.COOC2H5 + H2O
Реакция эта обратима; она не протекает до конца, так как образующиеся сложный эфир и вода в свою очередь вступают во взаимодействие друг с другом, давая обратно кислоту и спирт. В смеси эквимолекулярных количеств кислоты и спирта равновесие устанавливается, когда вступят в реакцию приблизительно 2/3 реагирующих веществ. Равновесие это не зависит от природы кислоты и спирта, а также от температуры, про которой протекает процесс; оно перемещается однако с изменением относительных количеств взятых в реакцию кислоты и спирта. Мы имеем здесь классический пример химического равновесия в однородной жидкой системе, изучение которого оказало ценные услуги при выяснении основных физико-химических законов. Существенное различие между процессом нейтрализации органической кислоты, с одной стороны, и образованием сложного эфира, с другой, заключается в скорости этих реакций. Тогда как образование соли даже при обыкновенной температуре происходит по вышеприведенному уравнению практически мгновенно, образование сложного эфира в тех же условиях температуры протекает настолько медленно (несколько дней), что, определяя титрованием количество еще не прореагировавшей кислоты в отдельных пробах, взятых в разные моменты, считая от начала реакций, можно измерять скорость этого процесса (см. этерификация). Температура имеет большое влияние на величину этой скорости, и при 100° та же реакция заканчивается уже в несколько часов. Такое же ускоряющее влияние оказывают минеральные кислоты, чем и пользуются при получении сложных эфиров органических кислот: их получают обыкновенно нагреванием смеси органических кислот со спиртом в присутствии серной или соляной кислот. Из других реакций, общих для всех органических кислот, следует упомянуть прежде всего их взаимодействие с галоидными, особенно хлористыми соединениями фосфора.
Получающиеся таким образом соединения общей формулы RCOCl называются хлорангидридами органических кислот и могут быть выведены из органических кислот замещением группы ОН хлором, что служит подтверждением того, что гидроксильная группа действительно входит в состав карбоксила. Из хлорангидридов легко получаются другие производные органических кислот: ангидриды, амиды и пр.
Общая классификация органических кислот отражает обычное подразделение органических соединений на предельные, непредельные, ароматические и гетероциклические, — в предельных одноосновных кислотах радикал R имеет насыщенный характер, и, следовательно, они способны только к реакциям замещения. Сюда относятся кислоты муравьиная, уксусная, пропионовая, масляная, из высших кислот этого ряда — пальмитиновая, стеариновая и т. д. Некоторые представители этой группы кислот в виде эфиров глицерина образуют главную составную часть большинства растительных и животных жиров. Вследствие этого предельные одноосновные кислоты называются иногда жирными кислотами. В непредельных кислотах радикал R имеет ненасыщенный характер. Таковы акриловая, кротоновая, из высших — олеиновая кислота и т. д. Для всех их характерны реакция присоединения галоидов, галоидоводородных кислот и т. п. Ароматические кислоты (бензойная, толуиловые и пр.), подобно бензолу и его гомологам, при непосредственном действии азотной и серной кислот легко образуют нитро- и сульфопроизводные. Таким образом, характер радикала R в общих чертах не меняется от соседства карбоксильной группы.
То же самое можно сказать и относительно гетероциклических кислот; они также удерживают характерные особенности тех ядер (пиролла, пиридина, хинолина и т. п.), производными которых они являются. К каждой из этих основных групп органических кислот примыкает целый ряд производных, образующихся путем замещения (непосредственного или обходным путем) одного или нескольких водородов радикала R на ту или иную группу или атом. Таковы галоидо-нитросульфопроизводные кислот, кето-, окси-, аминокислоты. Обладая всеми общими свойствами органических кислот, такие кислоты имеют в то же время групповые отличия, которые обусловливаются прежде всего характером заместителя. Так, например, в кетокислотах наряду с кислотными свойствами появляются характерные свойства кетонов, в аминокислотах — основные свойства аммиака и т. п. Кроме характера заместителя, весьма существенную роль играет его положение по отношению к карбоксилу. Так, например, вступление галоида в радикал R резко повышает константу диссоциации (силу) кислоты, но только лишь в тех случаях, когда галоид становится в α-положение, т. е. у соседнего с карбоксилом углерода; в других случаях (β-, γ-положения) влияние этого заместителя на силу кислоты несравненно меньше, а иногда даже вовсе не наблюдается.
В качестве другого примера того влияния, которое оказывает положение заместителя на свойства органических кислот, можно бы привести различие в направлении реакции отщепления воды для α-, β-, и γ-оксикислот, причем получаются совершенно различные продукты. Вывод двух-, трех- и вообще многоосновных органических кислот из кислот одноосновных сводится к замещению одного или нескольких водородов радикала R на соответствующее число карбоксильных групп, причем большей частью пользуются для этой цели взаимодействием соответствующего галоидопроизводного и цианистого калия. Так, например, при действии KCN на монохлоруксусную кислоту СН2Сl.СOOH получается кислота циануксусная СН2(CN)СООН, которая при омылении дает двухосновную малоновую кислоту, СН2(СООН)2. Вступление второго карбоксила в молекулу, прежде всего, повышает константу диссоциации (силу) органической кислоты; особенно сильно это влияние оказывается в тех случаях, когда вторая карбоксильная группа оказывается возможно близко к первой: например, щавелевая кислота (СООН)2 приблизительно в 5000 раз сильнее уксусной СН3.СООН. Далее появляется способность образовать наряду со средними также и кислые производные (соли, эфиры и т. п.). В ряде других свойств органических кислот высшей основности существенную роль играет взаимное положение карбоксильных групп. Так, например, двуосновные кислоты типа малоновой, т. е. с двумя карбоксилами при одном углероде, легко отщепляют углекислоту, переходя в соответствующие одноосновные кислоты, например, малоновая — в уксусную и т. п. При положении карбоксилов у соседних углеродов (янтарная, фталевая кислоты) появляется склонность к отщеплени воды и образованию ангидрида и т. д. Органические кислоты, принадлежащие к одной и той же группе, отличаются друг от друга весом и строением радикала R. Факторы эти отражаются главным образом на физических свойствах и силе органических кислот. Так, например, t° кипения жирных кислот с увеличением веса радикала R постепенно возрастает, причем гомологическая разность для этой константы по мере перехода от низших гомологов к высшим постепенно уменьшается. Сложнее закон изменения температуры плавления органических кислот. Повышение с возрастанием веса радикала R и здесь наблюдается. Однако как одноосновные, так и двуосновные кислоты жирного ряда с четным числом атомов углерода в частице плавятся выше, чем ближайшие к ним высшие гомологи с нечетным числом углеродов. Иначе сказывается увеличение веса радикала R на константе диссоциации органических кислот и на их удельном весе. По мере перехода от низших гомологов, например, жирных кислот, к высшим константам эти медленно уменьшаются так, что высшие кислоты оказываются и слабее, и легче низших. Наконец, структура радикала R также заметно отражается на уазанных свойствах органических кислот. Так, например, кислоты с нормальной цепью углеродных атомов имеют сравнительно наиболее высокую температуру кипения, кислоты же третичные [например, триметилуксусная (СН3)3С.С00Н] кипят наиболее низко. Вместе с тем кислоты этого последнего типа имеют наименьшую константу диссоциации, т. е. являются по сравнению со своими изомерами кислотами наиболее слабыми.
С. Наметкин.
| Номер тома | 30 |
| Номер (-а) страницы | 638 |
