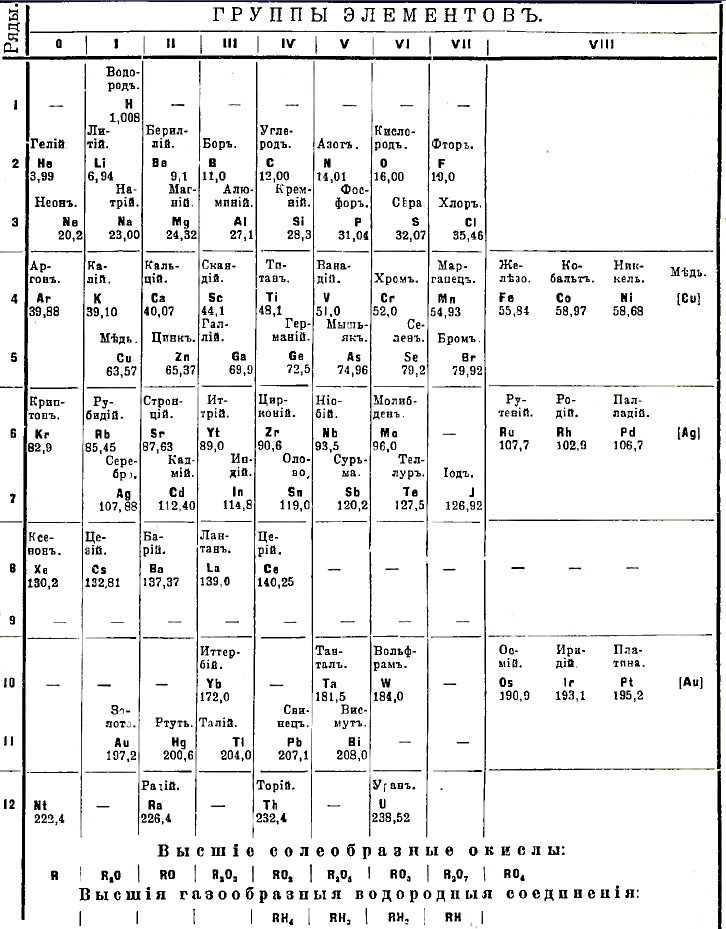
Периодическая система элементов
Периодическая система элементов (или периодический закон) была установлена в 1869 г. Д. И. Менделеевым. Будучи профессором петроградского университета и собирая материал для своих лекций по неорганической химии, Д. И. Менделеев выписывал на отдельных карточках названия элементов, их атомные веса, главнейшие их свойства, как физические (удельный вес, температуру плавления и т. п.), так и химические (как-то: формулу окисла, соединения с водородом и т. п.). Располагая затем элементы по возрастающим их атомным весам, Д. И. Менделеев заметил, что свойства элементов постепенно изменяются: на первом месте стоит водород (Н=1), как типический элемент, затем существует скачок в 6 единиц, и начинается ряд элементов: литий (Li=7), бериллий (Ве=9), бор (В=11), углерод (С=12), азот (N=14), кислород (O=16), фтор (F=19), в котором наблюдается постепенный переход от такого металла, как литий, через промежуточные элементы к такому металлоиду, как фтор. Переход же к следующему элементу, натрию (Na=23), представляет резкий скачок, ибо натрий повторяет свойства лития, следующий же металл магний (Mg=24) свойства бериллия, алюминий (Аl=27) — бора, кремний (Si=28) — углерода, фосфор (P=31) — азота, сера (S=32) — кислорода и, наконец, хлор (СІ=35,5) — фтора; затем опять скачок к металлу калию (K=39), который подобен литию и натрию, и т.д. Таким образом, мы видим, что свойства соединений элементов находятся в периодической зависимости от их атомного веса, ибо, постепенно изменяясь с увеличением атомного веса, они при изменении последнего на известное число (для первых рядов на 16—19, а для последующих — больше, см. таб.) повторяются; каждый восьмой элемент подобен тому, который мы будем считать за первый, например, алюминий - бору, кремний — углероду, хлор - фтору и т. д. Д. И. Менделеев разместил все элементы в таблицу, состоящую из восьми групп и 12 рядов, в XX же столетии, с открытием аргона, гелия и т. п. благородных газов, эта таблица дополнилась новой группой, так называемой нулевой. В прилагаемой таблице приведены атомные веса, как они приняты для 1912 г. Внизу таблицы указаны: 1) формула высшего окисла, солеобразующего, т. е. основания или ангидрида кислоты, причем номер группы (I, II и т. д.) соответствует числу атомов кислорода, приходящегося на два атома элемента, в высшем окисле, и 2) состав водородистых соединений.
В 1-м горизонтальном ряду Д. И. Менделеев поместил один водород в І-й группе; во 2-м ряду находятся Li, Be, В, С, N, О, F; 3-й ряд начинается с неона (Ne), находящегося в нулевой группе, а за ним следует Na и т. д. Таким образом, тот резкий переход, от фтора к натрию, который наблюдался в 1871 г., в настоящее время сгладился; фтор — элемент с резко выраженными электроотрицательными свойствами (т. е. свойствами металлоидов), натрий же — с таковыми же электроположительными, переход же от одного к другому совершается через неон — элемент совершенно нейтральный, в котором оба противоположные электричества как бы совершенно уравновесились. То же самое можно сказать про переход от хлора к калию через аргон, брома — к рубидию через криптон, йода — к цезию через ксенон; вообще переход элемента нечетных рядов (3, 5 и 7-го) к элементам четных (4, 6 и 8) совершается через элементы нулевой группы. Что же касается до перехода от четных рядов (4-го, 6-го, 10-го) к элементам нечетных рядов (5-го, 7-го, 11-го), то он совершается через восьмую группу, которая содержит в каждом ряду по три элемента: в 4-м — Fe, Ni, Со, в 6-м — Ru, Rh, Pd, и в 10-м — Os, Ir, Pt. Начиная с 4-го ряда, наблюдаются большие периоды, состоящие из двух малых; таких периодов три: первый состоит из 4-го и 5-го ряда, второй — из 6-го и 7-го, третий из 10-го и 11-го ряда. Эта двойная периодичность наблюдается в том, что элементы четных рядов в каждой группе (например Li, K, Rb, Cs или Ca, Sr, Ba) образуют как бы одну подгруппу, характеризующуюся чертами более тесной и близкой аналогии своих членов. То же можно сказать про элементы нечетных рядов (например Р, As, Sb, в V-ой группе, СІ, Вг, J и т. п.). Вообще можно сказать, что элементы нечетных рядов во всей периодической системе обладают некоторыми общими свойствами (например, способностью образовать газообразные водородистые соединения, металлоорганические и т. п.); они большей частью — диамагнитны, элементы же четных рядов — парамагнитны и т. д. Элементы 2-го ряда (Li, Be, В, С, N, О, F), обладающие наименьшими атомными весами, «отличаются резкостью свойств», Менделеев назвал их типическими. Про водород, Н=1, Д. И. Менделеев говорит: «как легчайший элемент, он по справедливости избирается, как самый типический». Типические элементы являются наиболее распространенными телами на поверхности земли и в атмосфере.
Изучение физических свойств элементов и их соединений показало, что они находятся в периодической зависимости от атомного веса. Лотар Мейер показал это для атомных объемов (значение коих получается при делении атомного веса (А) на плотность (d); v = A/d).
Если расположить по горизонтальной оси (абсциссе) атомные веса, а по вертикальной (ординате) атомные объемы, то получается кривая, явственно показывающая периодичность атомных объемов: вершины этой кривой занимают элементы І-й труппы: Li, Na, K и т. д. По нисходящим ветвям находятся щелочноземельные металлы (Са, Sr, Ва), по восходящим — галоиды (Сl, Вг, J) и т. д. Аналогичные кривые получаются для других физических свойств элементов: сжимаемости, температуры плавления, коэффициента расширения, твердости и т. д. Укажем только, что кривая температуры плавления показывает следующую картину: ее максимумы совпадают с минимумом кривой атомных объемов и обратно, т. е. элементы с большим атомным объемом обладают низкой температурой плавления (большей частью).
Такая же периодичность свойств наблюдается для оптических (т. е. светопреломляемости, поглощения света и т. п.), электрических, магнитных и вообще для всех изученных свойств, причем не только для элементов, но и их соединений.
Что касается до химических свойств, то нужно отметить, что в свободном состоянии элементы, находящиеся в одной и той же группе, могут довольно резко отличаться друг от друга, как, например, кислород и сера в шестой группе, азот и фосфор — в V-й; аналогия же свойств наблюдается в их соединениях. Как было выше указано, номер группы указывает число атомов кислорода, приходящихся на два атома элемента в его высших кислородных соединениях, иными словами, он численно равен высшей атомности (или валентности) этого элемента по кислороду. Изменение валентности элементов по водороду видно из таблицы для последних 4-х групп (IV—VIII), и для них сумма валентности по кислороду и таковой по водороду равна 8. Степень постоянства атомности, а также сравнительная степень устойчивости соединений, отвечающих различной атомности, правильно изменяются в проделах периодической системы. Наиболее постоянной атомностью отличаются элементы первых трех (I—III) групп, особенно принадлежащие к четным рядам: элементы же нечетных рядов обнаруживают большее разнообразие, в общем возрастающее с повышением атомного веса (например, для ртути Hg3О и HgO, для индия известны соли ІnХ, ІnХ2, и InХ3). В ІV-й группе непостоянство атомности наблюдается для элементов как четных, так и нечетных рядов, а в следующих V—VII группах оно очень распространенное явление, причем в четных рядах наиболее устойчивыми являются соединения высшего типа, в нечетных же рядах устойчивость соединений с высшей атомностью падает, и наиболее устойчивыми являются соединения низших типов; например, для свинца соединение типа РbХ4 является менее устойчивым, чем РbХ3.
В периодической системе можно заметить три направления, по которым совершается постепенное и правильное изменение металлического (электроположительного) характера в металлоидный (электроотрицательный). 1) Первое направление было указано выше: в первых горизонтальных рядах от элементам І-й группы к VІІ-й мы наблюдаем постепенный переход от таких типических металлов, как Li, Na, к таким типическим металлоидам, как F, Сl и т. д. 2) При движении в вертикальном направлении, т. е. в пределах одной и той же группы, замечается повышение металлических свойств элементов, а следовательно, и возрастание основных свойств их окислов, с увеличением атомного веса; это наблюдается как для первых (например, для K, Rb, Cs, и Са, Sr, Ва), так и для IV—VII групп (Р, As, Sb, Вu, и Si, Sn, Pb и т. п.). 3) Элементы четных рядов проявляют большую металличность свойств, чем таковые нечетных рядов: так, в VII группе марганец, в VI — хром (в 4-м ряду) в свободном состоянии являются металлами; их низшие окислы (МnО, Мn2O3, Сr, O3) представляют основания и более устойчивы, чем высшие кислотные ангидриды (Мn3O, и СrO3) Из вышесказанного следует, что наиболее электроотрицательный элемент (металлоид) должен занимать правое верхнее (оно и занято фтором), а наиболее электроположительный (металл) — левое нижнее место (где находится цезий, обладающий наиболее электроположительными свойствами).
Д. И. Менделеев при самом установлении периодической системы указал на то, что она «открывает новые аналогии и тем самым намечает новые пути для познания элементов» и воспользовался ею, во-первых, для исправления атомных весов элементов, во-вторых — для предсказания свойств еще неоткрытых элементов. Им были исправлены атомные веса индия, урана, бериллия и др. Рассмотрим установление атомного веса индия. Химический анализ позволяет с точностью определить, что в окиси индия на 16 весовых частей (в. ч.) кислорода приходится 75,4 в. ч. индия. Но на основании этого, мы можем только тогда определить атомный вес, когда узнаем формулу его окиси. Придавая последней формулу In2О, мы получим для атомного веса In=37,7; если же окись индия ІnО, то Іn=75,4 и т. д. Такой атомный вес для индия принимался ранее, но Д. И. Менделеев, принимая во внимание, что в таком случае для индия нет подходящего места в периодической системе (место с атомным весом в 75 занято мышьяком), предложил изменить формулу окиси индия в Іn2O3, и тогда получаем Іn=11З. Это число было подтверждено на основании величины теплоемкости, определенной Д. И. Менделеевым (0,55) и Бунзеном (0,57). Точно так же Д. И. Менделеевым было указано на то, что атомные веса Os, Іr, Pt, Au определены неточно, это и подтвердилось впоследствии.
Прозорливость ума Д. И. Менделеева обнаружилась в том, что он решился предсказать свойства неизвестных дотоле элементов. Подобно тому, как, зная широту и долготу какого-либо места на земном шаре, мы можем судить о многих климатических и физических его свойствах, так и место, занимаемое элементом в периодической системе, указывает «величину атомного веса, аналогию, свойства и формулу высшего окисла, водородного и других соединений — словом, главные количественные и качественные признаки элемента». Указав затем, что атомный вес селена является средним арифметическим из таковых для S, Те, As и Вr, а его физические и химические свойства могут быть определены по свойствам вышеуказанных элементов, Менделеев предугадал свойства экабора, экаалюминия и экасилиция. (Так он предложил назвать эти элементы, чтобы показать их аналогию с бором, алюминием и т. д. Эка по-санскритски — один). Открытые впоследствии скандий (Клеве и Нильсоном), галлий (Лэкок-де Буабодраном в 1876 г.) и германий (Кл. Винклером в 1886 г.) оказались сходными с экабором, и т. д.
Следующая таблица показывает, насколько близко совпадение между наблюдаемыми фактами и предсказаниями Д. И. Менделеева:
|
Экакремний. Находится между Si, Sn. Атомный вес около 70. Трудноплавкий металл; может быть получен восстановлением при помощи угля или натрия из окиси. С трудом поддающийся действию кислот, но в щелочах растворимый EbO2 окисел менее основного характера, чем TiO2, но более, чем SiO2. EbCl4 – жидкость, кипит ниже 100˚С. |
Германий (открыт Винклером в 1886 г.). Атомный вес = 72,04 (Н = 1). Получается восстановлением из окиси углем или водородом. Слабая соляная кислота на него не действует; он окисляется азотной кислотой, раствор – в серной. Растворим в щелочах GeO2 – кислотный ангидрид, GeCl4 – жидкость, кипит при 86˚С. |
Когда были открыты аргон и гелий, то для них вначале не находилось места в периодической системе, но последующие затем исследования ознакомили нас с целой группой благородных газов, образующих нулевую группу элементов, дополнившую периодическую систему. В 1903 г. Д. И. Менделеев предложил дополнить периодическую систему еще одним нулевым рядом с элементом х, атомный вес коего лежит между 0,00000096 и 0,000000000053 (мировой эфир?); в нулевой же группе, быть может, над неоном, находится элемент у (с атомным весом около 0,4) (короний?).
В заключении мы должны указать на те отступления от периодической системы, которые наблюдаются и до сих пор остаются неразъясненными: для ряда элементов атомный вес показывает одно место, а по своим свойствам они занимают другое: аргон с атомным весом (а. в.) 39,88 должен стоять после калия (с а. в. 39,10), кобальт (а. в. 58,97) — после никеля (а. в. 68,7), теллур (а. в. 127,5) — после йода (а. в. 126,92), а по своим свойствам они занимают места предшествующие (см. табл.). Равным образом целая группа т. н. редкоземельных элементов (церий, лантан, европий и мн. др.) не находят себе места в периодической системе. Профессор Бог. Браунер предлагает все их поместить в одно место (IV—8), на котором до сих пор стоял один церий, подобно тому, как в VIII группе периодической системы одно место занимают 4 элемента.
Факты эти указывают, что периодическая система, как и все то, что создано человеческим разумом, не представляет собой чего-либо вполне законченного и совершенного, что дальнейшие исследования внесут в нее новые дополнения, изменения и позволят, основываясь на периодической системе, создать новую более полную и совершенную классификацию элементов. Это, конечно, нисколько не умаляет заслуг ее творца, Д. И. Менделеева, и других ученых, своими трудами укрепивших и расширивших периодическую систему.
Успехи XX столетия в области изучения строения материи, основанные на изучении радиоактивности элементов, катодных, рентгеновых и т. п. лучей и послужившие основанием для создания электронной теории, поставили на очередь вопрос о строении атомов, и ответ на него должен так или иначе отразиться на развитии периодической системы. Самая периодичность свойств элементов и их зависимость от атомного веса заставляла предполагать, что есть нечто общее в атомах различных элементов, и это общее — какая-либо единая форма материи (протил, как предложил назвать Крукс и т. д.); но сам Д. И. Менделеев упорно отрицал основательность подобного рода допущения и был близок в своих взглядах с мнением, высказанным (в 1875 г.) знаменитым английским физиком Кл. Максвеллом, согласно коему атомы элементов суть нечто постоянное, от века существующее, и для них борьбы за существование не существует. Но с тех пор многое изменилось в наших взглядах, в учение об элементах введено понятие о продолжительности жизни того или другого элемента (см. радиоактивность), и предложены различными учеными теории, объясняющие строение атомов элементов и периодичность их свойств. Из них наиболее разработанной является теория Д. Д. Томсона, по коей атом элементов представляет ядро, составляющее положительное электричество, в коем расположены в известном порядке и числе электроны, т. е. атомы отрицательного электричества. Не излагая в подробности эту теорию, укажем, что Д. Д. Томсон, принимая, что свойства элементов зависят от числа электронов, заключающихся в атомах, объяснил периодичность свойств.
В заключении укажем, что отношение ученых к периодической системе было различно в разных странах: во Франции Бертло, Муассан и др. не придавали ей большого значения, в Германии — тоже, наибольшее же уважение ее творцу, Д. И. Менделееву, и признание его заслуг было оказано в Англии, стране, считающей в числе своих ученых Ньютона, Бойля, Деви, Фарадея, К. Максвелла и мн. др. исследователей, и наибольшее число исследователей, укрепивших своими трудами периодическую систему, мы видим в Англии и Америке. Главная литература: Д. И. Менделеев, «Основы химии», I изд. в 1869 г., 8-е в 1908 г. Н. А. Морозов, «Периодические системы строения вещества» (1907). Л. А. Чугаев, «Периодическая система химических соединений» (1913. В этом труде излагается довольно подробно история вопроса, а также собрано много интересных результатов различных исследователей). Loth. Meyer, «Die modernen Theorien der Chemie» (5 Aufl. 1884). F. Р. Venable, «The developpment of the periodic law». А. Е. Garrett, «The periodic law» (1909).
И. Каблуков.
| Номер тома | 31 |
| Номер (-а) страницы | 586 |
