Платина
Платина, химический знак Pt, атомный вес 193,4, точка плавления 1746° (по Нернсту), удельный вес 21,48. В природе встречается в самородном виде, но никогда в чистом, а обыкновенно с примесью палладия, иридия, рутения, родия и осмия; последние металлы суть постоянные спутники платины и потому называются металлами платиновой группы; кроме того, часто с примесью меди и железа. Главное месторождение платины — Урал; в незначительных количествах попадается в Калифорнии, Бразилии, Борнео, Доминго и Австралии.
Металлическая платина имеет белый, несколько с синеватым оттенком цвет, вполне металлический блеск и, сваренная, отличается большей твердостью, чем сплавленная. В нагретом состоянии куется, сваривается и вытягивается в тонкую проволоку. Незначительные примеси других металлов сильно понижают ковкость; поэтому продажная, обычно содержащая иридий, платина гораздо хрупче, чем чистая. Платина принадлежит к тугоплавким металлам, почему и находит применение как материал для тиглей, употребляемых в химической лаборатории. Легко плавится платина в известковом тигле в пламени гремучего газа и светильного газа, сжигаемого в струе кислорода (на лампе Девиля). В белокалильном жару два платиновые куска свариваются; в красно-калильном — платиновые сосуды пропускают через стенки водород; другие же газы не диффундируют. На воздухе не изменяется, даже в сильном жару не окисляется; кислоты: соляная, азотная, серная и плавиковая на нее действуют крайне незначительно. Ввиду этого, платиновые сосуды употребляются на заводах для упаривания камерной серной кислоты до крепости в 66° Б. Только царская водка легко и вполне растворяет платину. Гидраты окисей калия, натрия, лития, а также хлористый литий сильно действуют на платину, равным образом и смесь селитры и окиси калия. Действует на платину смесь угля и кремнезема, образуя хрупкую кремнистую платину; ввиду этого не рекомендуется платиновые тигли нагревать между углями. Губчатая платина получается прокаливанием аммониевого хлороплатината (NH4)2 PtCL6, — представляет серую губчатую массу, которая при белом калении и при сильном давлении сваривается в компактную массу и принимает металлический блеск полированной стали. Платиновая чернь — черный, подобно углю, тяжелый порошок, принимающий при давлении белый цвет и металлический блеск, есть не что иное, как металлическая платина в состоянии весьма тонкого измельчения. Получается платиновая чернь восстановлением платиновых соединений (винным спиртом, сахаром, формалином) в щелочной среде. Платиновая чернь и губчатая платина имеют способность поглощать газы, особенно кислород; объем платиновой черни может сгустить в своих порах несколько сот объемов кислорода. Свойство мелко раздробленной платины сгущать в своих порах кислород и давать легко восстановимые низшие степени окисления на поверхности своих раздробленных мелких частиц — обусловливает окислительное действие платина в этих состояниях уже при обыкновенной температуре. Окислителем является кислород, воздуха. Благодаря способности платиновой черни ускорять окисление, в технике платина в виде черни употребляется для окисления сернистого газа в серный ангидрид, винного спирта в уксусную кислоту и т. д. Для окисления сернистого газа в серный ангидрид признается наилучшей температура в 400°, так как при этой температуре получаются наибольшие выходы SО3. Такое действие (ускорять и повышать окисление) платины называют контактным, или каталитическим (см. катализ). Платина находит применение для химических и электрохимических целей, а также как материал химических сосудов (тигли, чашки, проволока, жесть), для изготовления реторт для упаривания серной кислоты; платиновые соли употребляются не только в химическом анализе, но и в технике, например для фотографии; в виде платиновой черни — в химических реакциях окисления. Благодаря редкости металла и вследствие его технического применения, в последние годы цена на платину сильно возросла. О месторождениях и добывании платины см. приложение.
Е. Орлов.
Добывание платины и ее соединения.
Самородная платина, встречающаяся в природе в россыпях, никогда не бывает чиста, представляя сплав платины с иридием, палладием, родием, железом, медью и иногда о осмием. Платиновые россыпи произошли чрез разрушение большой массы горных пород, в которых платина представляет еще гораздо меньшее содержание, чем в россыпях. Спутниками зерен и листочков самородной платины в россыпях являются зерна кварца, серпентина, циркона, корунда, титанового и хромистого железняков, золота и т. п. Платиносодержащий песок ничем не отличается по внешнему виду от обыкновенного песка. Среднее содержание платины в этом песке Керль считает 6—8 г на 1000 кг, иногда оно поднимается до 40 г или падает до 2,6 г. Получение платины из россыпей распадается на 2 части: выделение самородной платины из носков и ее очищение. Извлекается самородная платина из песков, как золото, промывкой; причем иногда еще подвергается обработке ртутью для извлечения золота. Продукт промывки поступает в продажу под названием сырой платины, или платиновой руды. О мировой добыче платины и добыче ее в России см. XV, 496, приложение статистика горного дела.
Сырую платину подвергают очистке или на специальных платиновых заводах, или на химических заводах. По описанию Луи, теперь в России перерабатывают платиновую руду так. Нагревают с царской водкой на песчаной бане в чашках в 0,6 м в диаметре. Раствор выпаривают досуха, остаток извлекают соляной кислотой, раствор снова выпаривают и обрабатывают остаток соляной кислотой, повторяя это до полного разложения азотной кислоты. Последний раствор отцеживается от осадка, который продается на германские химические заводы, перерабатывающие его на металлы платиновой группы. Раствор же осаждают нашатырем (NH4Cl); нашатырный осадок промывают на особых фильтрах с насосом и получают его в виде плиток. Его высушивают медленно и прокаливают в муфеле на платиновых пластинках. Получается плитка губчатой платины. Ее измельчают и спрессовывают в стальной ступке Абиха, после чего сплавляют в печи Девиля. Сплавленная платина отливается в формы, сделанные из известкового туфа. Получаются болванки толщиной в 5 см. Нашатырный маточный раствор, отцеженный от хлороплатината, содержит еще платину. Ее осаждают железом и затем рафинируют как сырую платину.
Платина образует с другими элементами соединения или по типу закиси PtX2 (например РtO, РtCl2) или по типу окиси PtX4 (например, РtO2, PtCl4); здесь — Х обозначает одновалентный элемент, например СІ. В химической практике чаще всего находит применение т. н. хлорная платина, добываемая растворением платины в царской водке при слабом нагревании; получается бурый раствор, из которого испарением можно выделить буро-красные призмы состава: H2PtCl6.6Н2О. Это вещество и носит название хлорной платины. При нагревании из этого соединения удаляется вода, НСІ, часть хлора; остается PtCl2, хлористая платина. Соединение же PtCl4 можно получить из H2PtCl6.6H2O при нагревании в струе хлора при 360°. РtCl4 выкристаллизовывается из водных растворов с 4Н2O. Соединение H2PtCl6 принимают за особого рода кислоту, называемую хлороплатиноводородной. Потому что существуют многочисленные солеобразные производные ее, в которых водород ее замещается металлом или аммониевой группой, например K2PtCl6, (NH4)2РtCl6; соединения эти носят название хлороплатинатов, например калия, натрия. Хлористая платина, PtCl2, нерастворима в воде, но в горячей соляной кислоте быстро растворяется, образуя в водном растворе кислоту H2PtCl4; соли этой кислоты, например, K2PtCl4, (NH4)2 РtСl4 — носят название хлороплатинитов (например, калия, натрия). Хлороплатинаты и хлороплатиниты называются комплексными солями. Комплексные соли вообще характеризуются тем, что при реакциях обмена роль одного из ионов играет сложный комплекс атомов, группирующихся около атома металла, как бы около центрального ядра, например: 1) K2РtСl6 + 2AgNO3 = Ag2PtCl6 + 2KСІ; 2) K2РtCl4 + 2AgNO3 = Ag2PtCl4 + 2KCl. Здесь комплекс атомов, группирующихся около атома платины, как бы около центрального ядра, (РtСl6), (РtСl4), играет роль отрицательного иона простой соли, например СІ в хлористом калии, КСІ.
Кроме вышеупомянутых солей, платина образует многочисленные сложные соединения, в которых играют роль ионов платиново-аммиачные комплексы, например Pt(NH3)4Х2 или Pt(NH3)6Х4, где Х=СІ, Вr, J, (NO3), ½ (SO4). В этих солях роль металла играет дву- или четырехвалентный комплекс, состоящий из атома платины и 4-х или 6 частиц аммиака. Как видно, валентность самой платины по отношению Х остается и после присоединения аммиака такой же, как и в простых ее соединениях: соединения Pt(NH3)4Х2 называются платозаминовыми солями и получаются из солей закиси платины, соединения Pt(NH3)6Х4 носят название платини-аминовых солей. Но для обоих рядов существуют соли и с меньшим содержанием аммиака, вообще с (NH3)n, где n = 6, 4, 3, 2 и 1. Убыль аммиака отражается на изменении свойств Х-ов: когда исчезает один аммиак, одновременно исчезает и один Х, как ион с его подвижностью, причем Х вступает в самый комплекс около платинs вместо ушедшего NH3; например:
[Pt(NH3)6]Сl4; [Pt(NH3)8/Cl2]Cl; [Pt(NH3)2/Cl4] и [Pt(NH3)8/Cl5]K. Изучение электропроводности растворов этих платиновых соединений явилось простым и быстрым средством для Вернера, решить, сколько Х-ов в данной соли обладают указанной подвижностью ионов. Изучая комплексные соединения платины, кобальта, хрома и т. д., Вернер отметил две характерные особенности их: 1) число молекул воды, аммиака и пр., присоединяющихся к молекуле металлической соли в гидратах, аммиакатах, число отрицательных атомов или остатков, входящих в состав комплексных солей, имеет строго определенное значение, чаще других повторяется 6, затем 4; 2) кислотные остатки, входящие в состав комплексных молекул: Cl, J, NO2, NO3, SO4 и пр. могут обладать существенно различным характером. В одних случаях остатки эти имеют характер типичных ионов, отличаются подвижностью, склонностью к реакциям солевого обмена, например [Pt.4NH3).Cl2; [Pt.4NH3)(NO3)2 и пр. В других случаях, наоборот, кислотные остатки прочно удерживаются комплексной молекулой, в обменное разложение вступают не моментально, как анионы солей, но сравнительно медленно; вообще скорее напоминают атомы или остатки, связанные с углеродом в органических соединениях, например, в С2Н5Cl; СН3СІ. Существуют также смешанные типы, где в одной и той же комплексной молекуле, наряду с легко подвижными и, следовательно, ионизированными кислотными остатками находятся малоподвижные и прочно связанные, например, в [Pt(NH3)8/Cl3]Cl. Для объяснения различных случаев комплексных соединений, Вернер предложил координационную теорию, по которой в каждой комплексной молекуле один атом (чаще всего металл, например, Pt, Со, Сr, Сu) занимает центральное положение (ядро), а около него уже группируются все остальные атомы, атомные группы и целые молекулы. Это будет центральный атом молекулы. Число атомов или групп, непосредственно примыкающих к центральному атому и могущих поместиться в так называемой внутренней, или первой координационной сфере, по Вернеру, строго ограничено, и притом не зависит от способа, при помощи которого осуществляется их связь с другими частями молекул. В громадном большинстве случаев оно не превышает 6; в некоторых случаях бывает меньше 6, например, 4. Когда число 6, то атомы или атомные группы, непосредственно окружающие центральный атом, расположены по углам некоторого октаэдра, в простейшем случае правильного; когда же число равняется 4, атомы или атомные группы располагаются по четырем углам четырехугольника или квадрата (рис. 1 и 2).
Распределение составных частей комплексной молекулы Вернер связывает с той второй особенностью комплексных соединений, на которую выше обращено внимание. Компоненты первой, или внутренней, сферы связаны непосредственно с центральным атомом и притом прочно, наподобие того, как хлор связан с углеродом в органических соединениях. Наоборот, компоненты внешней сферы связаны с центральным атомом чрез посредство других атомов или групп, легко подвижны и склонны к ионизации. Для разъяснения разберем несколько случаев из группы платозаминовых соединений. Например, при действии NH3 на двухлористую платину, PtCl2, в зависимости от условий, образуется несколько различных соединений; из них мы остановимся здесь только на четырех. Одно из них содержит 4 молекулы NH3, например, PtCl2.4NH3 три остальных отвечают одной и той же эмпирической формуле PtCl2.2NH3. Соединение PtCl2.4NH3, т. н. хлорид 1-го основания Рейзе, легко реагирует с ляписом, причем оба атома хлора замещают остаток азотной кислоты: PtCl2.4NH3 + 2AgNO3 = Pt(NO3)3 4NH3 + 2AgCl; а также с влажной окисью серебра оно дает 2АgСІ и Pt(OH)2. 4NH3, представляющее сильную щелочь. Отсюда ясно, что в этой соли Рейзе оба атома хлора носят характер ионов (анионов) и что группа Pt.4NH3, представляет из себя двухвалентный катион Pt4NH3, и потому координационная формула хлорида первого основания Рейзе будет [Pt 4NH3] Cl2; гидрата: [Pt. 4NH3](OH)2, азотнокислой соли [Pt. 4NH3](NO3)2 и т. д. Из трех других упомянутых соединений с общей эмпирической формулой РtCl2.2NH3, два, довольно похожие друг на друга (малорастворимые тела желтого цвета), трудно и медленно реагируют с ляписом и вообще мало склонны к реакциям обменного разложения. Очевидно, атомы хлора в них не ионизированы (или с трудом переходят в состояние ионов), и потому, по Вернеру, им следует приписать координационное строение [Pt.2 NH3Сl2); другими словами: все составные части молекулы здесь помещаются во внутренней сфере, в непосредственной связи с атомом платины. Однако, вещества эти различаются во многих отношениях (по кристаллической форме, растворимости, реакциям) и получаются различным образом. Одно из них, носящее название хлорида 2-го основания Рейзе, образуется при отщеплении 2 молекул NH3 от хлорида [Pt 4NH3] Cl2 при нагревании последнего или при действии на него соляной кислотой. Другое, с названием соли Пейроне, получается при действии NH3 (в сравнительно небольшом количестве) на раствор Рt Cl2 в соляной кислоте, или же на двойную соль Pt Cl2. 2 KСІ. Оба эти основания при действии NH3 дают хлорид 1-го основания Рейзе [Pt. 4NH3] Cl2. Все это свидетельствует в пользу того, что они обладают одинаковым молекулярным весом и, следовательно, изомерны. Различие их обусловливается различным пространственным расположением атомов 2 NH3 и Cl2 в молекуле; но об этом будет упомянуто дальше. Третье (последнее) соединение эмпирической формулы PtCl2. 2NH3, отличающееся очень трудной растворимостью в воде и зеленым цветом, носит название соли Магнуса. Судя по эмпирической формуле, оно изомерно с двумя предыдущими, но, в отличие от них, обладает вдвое более сложной формулой. Известно, что KСІ, NaCl, NH4Cl легко соединяются с двухлористой платиной, PtCl2, давая соединения типа PtCl2. 2MeCl или PtCl2.MeCl2 и т. д. (Me=Nа, Kа, NH4, Мg). Образующиеся простые соединения суть соли некоторой двухосновной комплексной кислоты формулы Н2 [PtCl4]: в этой кислоте платина входит в состав аниона [Pt СІ4], а водород играет роль катиона. Вышеупомянутые двойные соединения должны быть рассматриваемы как соли такой комплексной кислоты K2 [Pt СІ4], Na2 [Pt Cl4], Мg [Pt СІ4]. При действии ляписа на эти двойные соли (хлороплатиниты) образуется серебряная соль той же комплексной кислоты в виде нерастворимого осадка сёможно-красного цвета: K2 (Pt Cl4) + 2Ag NO3 = Ag2 (Pt Cl4) + 2 KNO3. Все хлороплатиниты дают эту характерную реакцию, а потому она может служить для распознавания солей Н2 (PtCl4). Вот если на вышеупомянутую соль Магнуса подействуем ляписом, то моментально зеленый цвет переходит в сёможно-красный, а исследование продуктов превращения показывает, что последнее выражается так [РtCl2. 2 NH3]2 + 2 Аg NO3 = Ag2[PtCl4] + [Pt. 4NH3].NО2. Ясно поэтому, что соль Магнуса есть продукт сочетания двух комплексных ионов: [PtCl4] (отрицательный) и [Pt 4NH3], (положительный) что она есть хлороплатинит 1-го основания Рейзе: [Pt. 4NH3]PtCl4. Верность этого заключения подтверждается ее синтезом: если слить бесцветный раствор соли 1-го основания Рейзе с красным раствором какого-нибудь хлороплатинита, то немедленно получится обильный осадок зеленой соли Магнуса:
[Pt 4NH3] Cl2 + K2 [PtCl4] = [Рt4NH3][РtCl4] + 2KСІ.
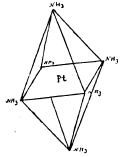
Рис. 1.
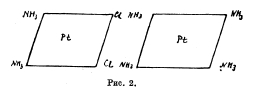
Рис. 2.
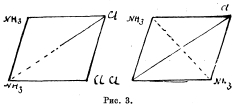
Рис. 3.
Чем же объясняется разница двух изомерных солей: соли Пейроне и хлорида 2-го основания Рейне. Соль Пейроне получается при действии NH3 на соли Н2РtCl4:
(NH4)2[Pt Cl4] + 2NH3 = [Pt.2 NH3Cl2] + 2NH4Cl.
Это кристаллический порошок оранжево-желтого цвета 1 весовая часть его растворяется в 26 весовых частях воды при 100° и в 387 частях при 0°. Хлорид 2-го основания Рейзе получается при отщеплении NH3 из соли 1-го основании Рейзе:
(Pt4NH3)Cl2 = (Pt2NH3Cl2) +2 NH3. Микроскопические октаэдры бледно-желтого цвета. 1 весовая часть растворяется в 160 весовых частях воды при 100° и 4472 весовых частях при 0°. При действии пиридина оба вещества дают различные, но притом изомерные между собой соединения, отвечающие общей координационной формуле (Pt2NH32Py).Сl2. (Здесь символом Ру обозначается пиридин). Изомерию солей Пейроне и Рейзе Вернер объясняет, исходя из плоскостной схемы, которая, по его представлению, должна отвечать координационному числу 4. Легко видеть, что здесь по теории возможны два и только два пространственных изомера, как это видно из следующих схем рис. 3. Переводя соли Пейроне и Рейзе в пиридиновые соединения, синтезируя те же пиридиновые соединения из пиридиновых солей, подобных вышеупомянутым солям Пейроне и Рейзе, и изучая отношение их к высокой температуре и к действию НСІ, Вернеру удалось доказать справедливость плоскостного представления обоих изомерных соединений.
Из платин-аминовых соединений получены соли разного состава, например:
[Pt(NH3)6]Cl4; (Рt(NH3)6] (NO3)4; [Рt(NH3)6] CO2; [Pt(NH3)6](SО4)2; [Pt(NH3)4/Cl2](NО3)2 и т. д. Интересно, что комплекс [Pt(NH3)6] имеет некоторое сходство с щелочноземельными металлами, так как углекислая и сернокислая соли его отличаются малой растворимостью в воде. При действии азотной кислоты на соль Магнуса, Гро получил белый порошок, так называемый хлороплатинидиамин-нитрат, состава: [Pt(NH3)4/Cl2](NО3)2. Это — азотнокислая соль Гро.
Получены соли: [Pt(NH3)4/ NО3](NО3)2 и [Pt(NH3)8/ (ОН)2](NО3)2 называются солями Жерара. Соль Клеве: [Pt(NH3)8/ Cl3]Cl – хлористый хлороплатинимонодиамин и т. д. и т. д.
См. Л. А. Чугаев, «О химическом строении комплексных соединений» (Спб. 1910).
Е. Орлов.
| Номер тома | 32 |
| Номер (-а) страницы | 317 |
