Реакция химическая
Реакция химическая. Основной химический закон гласит, что материал, состоящий из одного или нескольких веществ, не переставая существовать, может превратиться в одно или несколько новых веществ (ср. сохранения материи закон); такое превращение называется реакцией химической, или взаимодействием. Виды реакции: соединение, когда два или несколько веществ превращаются в одно, например, железо и кислород дают окись железа, известь (окись кальция) и вода дают гашеную известь (гидроокись кальция); разложение (см.), когда одно вещество разлагается на два или несколько, например, окись ртути разлагается на кислород и ртуть; вытеснение (см. XX, 503), когда простое вещество, вступая во взаимодействие со сложным, освобождает другое простое вещество, само входя в новое сложное вещество, например уголь, действуя на кремнезем (SiО2), дает кремний (Si) и окись углерода (СО); двойное разложение (см.), когда два соединения обмениваются своими составными частями, например хлористый барий (ВаСl2) и серная кислота (Н2SO4) дают сернокислый барий (BaSO4) и соляную кислоту (НСl); замещение (см. XX, 503/05) — частный случай двойного разложения, когда простое вещество, действуя на сложное, приводит к образованию двух сложных веществ, например хлор (Сl2) и вода (Н2O) в результате реакции дают хлорноватистую кислоту (НСlO) и хлористый водород (НСl): Н2O + Cl2 → HClO + HCl. Частные группы тех или иных реакций получили особые названия: диссоциация (см.), гидролиз (см.), окисление (см. окислы), восстановление (см. XI, 22) и др.
Если продукты реакции химической не удаляются из реакционной среды, то в принципе реакции не доходят до конца, так как все они являются обратимыми, т. е. идет не только реакция А + В → С + D, но и обратная С + D → А + В; в тех случаях, когда обратимость реакции достаточно резко выражена, уравнение реакции пишут так: А + В ↔ С + D.
Реакции химические протекают с весьма разнообразными скоростями, имеются реакции от почти моментальных (взрывы) до весьма медленных, идущих годами; глава физической химии, изучающая скорости реакций, называется химической кинетикой (см. химия, XLV, ч. 2, 327/32).
Кинетика различает простые и сложные реакции. Когда в данной среде протекает одна только реакция, охватываемая одним химическим уравнением, реакция называется простой. Простые реакции различаются своим порядком, определяемым числом молекул, вступающих в реакцию. В реакциях 1-го порядка — мономолекулярных — превращению подвергается одно вещество: А→В или А→В+С; примеры: превращение одного изомера в другой или разложение, скажем, азотного ангидрида: N2O5→N2O3+O2. П реакциях 2-го порядка — бимолекулярных — две молекулы вступают в реакцию: А+В→C+D+… или 2A → C+D+…; пример: омыление сложных эфиров щелочами — (эфир) C2H5OCOCH3 + NaOH→C2H5OH (спирт) + CH3CO2Na (соль уксусной кислоты). Более редки реакции высших порядков три-, тетрамолекулярные и т. д.
В сложных реакциях одновременно в данной среде протекают две или больше реакции. Главнейшими из сложных являются обратимые, параллельные, последовательные и сопряженные реакции. В обратимых реакциях одновременно идут две реакции в двух противоположных направлениях, они также различаются порядком, как и простые реакции. К обратимым реакциям 1-го порядка типа А↔В принадлежат обратимые превращения двух изомеров; 2-го порядка типа A+B↔C+D принадлежит этерификация, образование сложных эфиров, например уксусно-этилового эфира из спирта и кислоты: С2Н5ОН+СН3COOH↔CH3CO2C2H5+H2O, где одновременно идет реакция воздействия воды на эфир.
Если данное вещество или группа веществ одновременно вступает в две реакции, которые протекают независимо друг от друга, то такие реакции называются параллельными, например, разложение бертолетовой соли при умеренном нагревании:
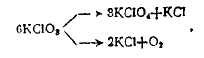
идущее в двух параллельных направлениях, в одном образуется хлорнокислый калий KClO4 и хлористый калий KО, в другом KО и кислород. Параллельные реакции не могут быть выражены одним химическим уравнением.
Весьма важны реакции последовательные, или реакции с промежуточными стадиями, в которых продукты первой реакции претерпевают дальнейшие превращения по типу А + В → С + D → Е + F →... Такие реакции могут быть необратимыми и обратимыми. Типичными последовательными реакциями являются радиоактивные превращения. Примером последовательной реакции может служить также действие кислот скажем – азотной, на крахмал при котором последовательно образуются декстрины, мальтоза, глюкоза, а в определенных условиях — окисляется и глюкоза.
Нередки случаи, когда вещества А и В в обычных условиях не вступают в реакции, но, если в их присутствии провести легко идущую реакцию А + С, то и вещества А и В, как бы заражаясь примером, взаимодействуют друг с другом. Такие реакции называются сопряженными. Пример: в водном растворе мышьяковистокислый натрий Na2HAsO3 не окисляется кислородом, но если в его присутствии провести окисление кислородом сернистокислого натрия Na2SО3, то и Na2HAsO3 окисляется. Здесь первичная реакция — Na2SO3+O2, вторичная — Na2HAsO3+O2. Такая передача способности реагирования называется химической индукцией, вещество А (здесь кислород) называется актором, вещество В (здесь Na2SО3) — индуктором, вещество С2 (здесь Na2HAsO3) — акцептором.
Все реакции по условиям среды бывают или гомогенными, или гетерогенными, в последнем случае реакция протекает в присутствии или с участием различных фаз. Гетерогенность вносит ряд усложнений, особенно на поверхностях раздела фаз (см. XLV, ч. 2, 332/40).
Скорость реакции химической отнюдь не может служить мерой сродства реагирующих веществ, так как она в сильнейшей степени может зависеть от присутствия посторонних веществ, не участвующих в самой реакции; такие вещества называются катализаторами, а самое влияние их на скорость реакции называется катализом (см.).
Как правило, реакции химические сопровождаются выделением или поглощением тепла, первые реакции называются экзотермическими, вторые — эндотермическими (см. термохимия, XLI, ч. 8, 568 сл.). Часто выделение теплоты в результате реакции велико, и такие реакции являются средством промышленного получения теплоты (см. горение, топливо).
Когда вещества вступают в реакцию, ясно, что существует сила, заставляющая их взаимодействовать; эта сила называется химическим сродством веществ. Знак этой силы определяет направление реакции; однако, ни скорость, ни тепловой эффект реакции не может дать ответа о величине этой силы. Вещества самопроизвольно реагируют, если их свободная энергия больше, чем свободная энергия продуктов реакции в заданных условиях температуры, давления и концентраций. А так как убылью свободной энергии определяется та максимальная работа, которую может сделать в термодинамически обратимых условиях система, то по этой максимальной работе мы судим о величине химического сродства реагирующих веществ, а следовательно, и о направлении, и о лучших условиях данной реакции (см. химия, XLV, ч. 2, 340/48).
А. Раковский.
| Номер тома | 36 (часть 1) |
| Номер (-а) страницы | 181 |
