Рефракция молекулярная
Рефракция молекулярная. Показатель преломления и светового луча при его переходе из пустоты в какое-либо изотропное вещество, зависит от рода этого вещества от рода луча, характеризуемого его длиной волны λ, и от состояния самого вещества, например от температуры и от внешнего давления, которые влияют на его плотность d. В разное время были предложены различные формулы, связывающие n и d. Главнейшие из этих формул следующие три:
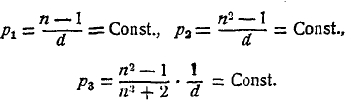
Первую формулу предложили Глэдстон и Дэль (Gladston & Dale, 1863), второй пользовался уже Ньютон, третью вывели одновременно Г. А. Лоренц (Н. А. Lorenz в Лейдене) и Л. Лоренц (L. Lorenz в Копенгагене) в 1880 г. Для газов и паров все 3 формулы совпадают, так как для этих веществ n весьма мало отличается от единицы. Во второй можно приближенно положить n2—1 = (n — 1) (n + 1) = 2(n—1), а в третьей n2+2 = 3, так что р2 = 2р1 и р3 =р1/3.
Однако, весьма точные измерения Магри (Magri, 1905) показали, что при увеличении давления до 193 атм. только 3-я формула оказывается согласной с опытами. Если сравнивать одно и то же вещество в газообразном, жидком и твердом состоянии, то формула р3 = Const, также оказывается гораздо ближе к действительности, чем остальные две. Проф. Д. А. Гольдгаммер (Казань) дал (1913) таблицу величин р3 для 20 веществ в жидком и в газообразном состояниях. Приводим некоторые числа:
|
|
H2O |
CO2 |
SO2 |
O2 |
N2 |
Ацетон |
Cl2 |
|
Жидк. |
0,2062 |
0,145 |
0,1587 |
0,1271 |
0,1592 |
0,2769 |
0,169 |
|
Газообразн. |
0,2068 |
0,147 |
0,1588 |
0,1259 |
0,1571 |
0,2769 |
0,160 |
Эти числа получены для желтой линии спектра натрия. Так как n зависит от λ, то это же относится и к числам р. Вообще можно сказать, что ни одна из 3 формул не подтверждается с точностью результатами опытов; смотря по роду изменения состояния вещества, та или другая формула представляет преимущества. По отношению к максимуму плотности воды при 4°С, ни одна из 3 формул не оправдывается, как показал впервые Жамен (Jamin, 1856).
Рефракцией молекулярной называется одна из величин р, помноженная на молекулярный вес М данного вещества. Если речь идет об элементе, то вместо М берется атомный вес А, и произведение называется атомной рефракцией. Для рефракции молекулярной мы имеем, таким образом, три выражения:
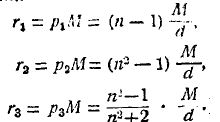
В настоящее время получила большое значение величина r3, которую обычно и подразумевают под названием рефракции молекулярной. Так как М не зависит от состояния вещества, то ясно, что все сказанное выше о величинах р относится и к величинам r. Относительно рефракции молекулярной мы имеем основной закон: рефракция молекулярная химического соединения равна сумме атомных рефракций его составных частей. Если бы этот закон точно соблюдался, то это означало бы, что рефракция молекулярная представляет свойство аддитивное. Если закон верен, то рефракция молекулярная изомеров должна быть одинаковая. Вопросом о рефракции молекулярной и о правильности приведенного закона занимались еще в прошлом столетии Лендольт (Landolt), Брюль (Bruehl) и Канонников (Казань). При этом за рефракцию молекулярную часто принималась не р3М, но р1М. Далее, атомные рефракции определялись чисто эмпирически, как бы ощупью, т. е. из ряда соединений отыскивались такие числа для атомных рефракций, которые удовлетворяли бы закону, и затем закон проверялся для других соединений. При этом оказывалось, что для атомов кислорода и углерода приходилось брать различные атомные рефракции в зависимости от того, какую роль играет атом в молекуле. Непосредственные измерения дали, впрочем, для свободных водорода и хлора числовые значения атомной рефракции, близкие к эмпирически найденным.
Закон r3 = р3М = Const, выражается формулой:
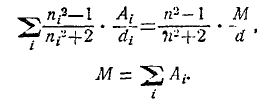
Здесь n, М и d относятся к химическому соединению, ni, Ai и di — к элементам, атомы которых входят в данную молекулу, причем каждый член должен быть взят столько раз, сколько раз атом встречается в молекуле. Д. А. Гольдгаммер вычислил атомные рефракции для 9 элементов и затем рефракции молекулярные для большого числа неорганических и органических соединений, вовсе не пользуясь эмпирическими значениями атомной рефракции. Приводим его числа для атомной рефракции элементов (r3):
H2=0,93; C=2,11; N2=2,20; O2=2,01; P(тв.)=9,22; S(тв.)=8,21; Cl2(жидк.)=5,99; Br2(газ)=8,39; I(газ)=14,70.
Д. А. Гольдгаммер вычисляет затем r3 для 20 газообразных соединений, причем для пяти согласие с наблюденными r3 неудовлетворительное, а для остальных хорошее. Для 20 жидких соединений получаются 4 неудовлетворительных, а для 10 твердых — 2 неудовлетворительных. В общем закон подтверждается только в известных пределах; это показывает, что атомы, соединяясь в молекулы, претерпевают какие-то изменения, влияющие на их атомную рефракцию. Но иногда согласие превосходное; так, для тростникового сахара (С12 Н22 О11), молекула которого состоит из 45 атомов, опыт дает r3=69,3, а вычисление r3=69,4. И. А. Вазастьерна (J. А. Wasastjerna, 1922) вычислил r3 для различных ионов, входящих в состав молекул, считая, что для последних r3 величина строго аддитивная. К. Фаянс и Г. Иос (К. Fajans и G. Joos, 1924) ввели поправку в эти вычисления.
В последние годы вопрос о рефракции молекулярной получил весьма большое значение в связи с быстро развивающимся учением о строении молекул, о расположении и в особенности о состоянии атомов, входящих в их состав. Тут наиболее важным является вопрос о деформациях, которым подвергаются атомы как нейтральные, так, в особенности, ионы, когда они химически соединяются. Деформации относятся к электронной оболочке атома, которая перестает обладать сферической симметрией, вследствие чего атом приобретает некоторый электрический момент m (он поляризуется), пропорциональный электрической силе ε, действующей на атом, так что m=εα, где α служит мерой способности атома подвергаться поляризации (деформации). Теория показывает, что r3 и α связаны формулой

где N=6,062·1023 (число Авогадро-Милликена). Вопросом о деформациях электрических оболочек атомов занимался в последние годы главным образом К. Фаянс (Мюнхен, с 1922 г.). Фаянс показывает, что всякое уклонение величины от строгой аддитивности есть признак деформации этих оболочек. Понятно, что изучение рефракции молекулярной должно играть весьма большую роль при определении состояния отдельных атомов в молекуле.
Литература: Е. Rimbach (обзор), «Beziehungen zwischen Lichtbrechung und chemischer Zusammensetzung der Кörper»; Graham-Otto's «Lehrbuch der Chemie», 1, 3 глава VI, стр. 567—665, 1898; Канонников, «Светопреломляющая способность химических соединений», Казань, 1884; Цитович, «Сборник физических работ в память Ф. Ф. Петрушевского», Пбг., 1904; Д. А. Гольдгаммер, «Дисперсия и абсорбция света», Берлин, 1913 (на немецком языке); К. Fajans (обзор), «Zeitschrift für Electrochemie», т. 34, № 9, стр. 502—518, 1928.
О. Хвольсон.
| Номер тома | 36 (часть 1) |
| Номер (-а) страницы | 589 |
