Сера
Сера, элемент, принадлежащий к третьему ряду VІ-й группы периодической системы. Атомный вес S=32,06 (0=16; 1922 г.). Температура плавления 114°,4 и 119°,2. Температура кипения 444°,5. Встречается в самородном состоянии (в вулканических местностях) и широко распространена в виде соединений, например, железного колчедана FeS2, медного колчедана FeCuS2, свинцового блеска (галенита) PbS, цинковой обманки ZnS и т. д. Кислородные соединения серы, как то — гипс, образуют иногда целые горы. Из гипса она выделяется в свободном виде благодаря жизнедеятельности бактерий и водорослей. Богатые залежи серы находятся на Кавказе в Дагестане. В Грузии находятся залежи серы в глинистом сланце (до 45%). Богатые залежи находятся также между Хивинским и Ахалтекинским оазисом, затем в бывшей Ферганской области и т. д. (Подробные сведения о месторождениях серы см. В. И. Вернадский, «Опыт описательной минералогии», СПБ., 1914, т. I, 480—527, а также — К. И. Богданович, В. Л. Ренгартен и А. Д. Нацкий, «Сера», вып. 23 «Естественные производительные силы России», Птгр., 1917). Несмотря на распространенность серы, общее количество ее в земной коре не более 0,1%.
Главным местом добычи серы в Европе является Сицилия. Там ее выплавляют, складывая кучи в закрытых помещениях, чтобы не произошло полного сгорания при зажигании ее в нижней части. Часть серы при этом сгорает, доставляя теплоту, на счет которой плавится остальная часть. Расплавленная сера стекает в особый приемник.
Нужно заметить, что выделяющийся при сгорании серы сернистый газ губит окружающую растительность и вредно действует на здоровье рабочих, и поэтому в новейшее время был предложен способ выплавлять серу с помощью водяного пара. Для этого пользуются горизонтальными цилиндрическими печами, в которые вводят вагонетки с продырявленным дном, наполненные породой, смешанной с серой. После того печи герметически закрывают и затем пускают водяной пар при давлении 4 атмосферы. Расплавляющаяся сера стекает через отверстие в дне вагонеток и собирается внизу печи.
Обширные залежи серы были открыты в Луизиане под слоем сыпучего песка, на глубине 150—240 м, но долгое время не знали выгодного способа ее получения, пока не был предложен следующий способ извлечения серы в жидком виде. Три концентрических железных трубы опускаются до уровня (рис. 1) залежей серы, и горячая вода под давлением пускается между стенками двух наружных труб, и так как вода находится под давлением, то ее температура поднимается выше точки плавления серы 114,5°. Горячая вода расплавляет серу, и последняя поднимается по средней трубе, конец коей находится ниже уровня расплавленной серы. Чтобы вынести серу на поверхность, по центральной трубе нагнетается воздух, который гонит кверху серу и пузырьки воздуха между стенками центральной и средней трубы. Добыча серы по этому способу возросла в Соединенных Штатах с 3,5 тыс. тонн в 1900 г. до 500 тыс. тонн в 1913 г.
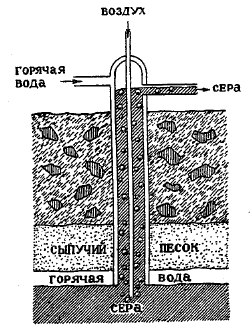
Рис. 1.
Движение добычи серы в Италии и Соединенных Штатах (доставляющих вместе 95% мировой добычи) видно на следующей таблице (в тыс. метрических тонн):
|
Годы |
Италия |
Соединенные Штаты |
|
1913 |
386,3 |
499,0 |
|
1914 |
377,8 |
424,4 |
|
1915 |
358,1 |
528,9 |
|
1916 |
269,4 |
660,1 |
|
1917 |
211,8 |
1152,6 |
|
1918 |
234,3 |
1375,2 |
|
1919 |
226,1 |
1209,7 |
|
1920 |
263,6 |
1275,4 |
|
1921 |
273,9 |
1909,3 |
|
1922 |
167,9 |
1860,3 |
|
1923 |
256,3 |
2068,8 |
|
1924 |
294,9 |
1240,2 |
|
1925 |
263,2 |
1431,9 |
|
1926 |
271,5 |
1920,4 |
Серу, полученную при выплавке, очищают перегонкой. Рис. 2 показывает реторту G и камеру А, служащие для этой цели. Поступающие в камеру пары серы вначале быстро охлаждаются и переходят прямо в твердое состояние, в виде очень тонкого порошка, так называемого серного цвета. Когда же стенки реторты нагреются, то сера из пара переходит в жидкость, которая скопляется на дне камеры, откуда ее выливают через отверстие (О) во влажные деревянные формы, причем получаются палочки комовой серы.

Рис. 2.
Сера является металлоидом (см. ХХVІII, 530 сл.), плохо проводит теплоту и электричество, не растворяется в воде, хорошо растворяется в эфире, хлороформе, сернистом углероде, бензине, углеводородах и т. п. Она является во многих аллотропических формах: двух кристаллических и нескольких аморфных. Расплавленная сера при медленном охлаждении застывает в прозрачные моноклинические призмы желтовато-бурого цвета, удельный вес 1,93, плавящиеся при 119,2°С. Кристаллы при хранении постепенно теряют прозрачность, ибо переходят в собрание кристаллов в виде октаэдров ромбической системы, удельный вес 2,05, плавится при 114°. Моноклинические кристаллы сохраняются при температуре выше 96°, тогда как ромбическая сера постоянна ниже 96°. Если кристаллы последней сохранять при температуре выше 96°, то они постепенно переходят в собрание моноклинических кристаллов. При 96° (точке перехода, или превращения) оба вида кристаллов могут существовать одновременно, подобно тому, как жидкая вода и лед при 0°. Выше 96° постоянна моноклиническая сера, ниже 96° — ромбическая. Если нагретую выше 330° серу медленно вылить в холодную воду, то получается полужидкая тягучая масса аморфной серы, которая может вытягиваться в нити и т. д. Через несколько дней эта так называемая пластическая сера становится твердой. Она состоит тогда из ромбической серы с большим количеством нового вида серы, нерастворимой в сернистом углероде. Такая же аморфная (нерастворимая) сера получается при выделении серы из растворов ее соединений при некоторых реакциях, — например, при действии кислот на серноватисто-кислый натрий (Na2S2О3), воды на хлорную серу, азотной кислоты на сернистые металлы и т. п.
Аморфная сера имеет более бледный цвет, чем обыкновенная. Серный цвет содержит оба вида аморфной серы, растворимый и нерастворимый. Кроме того, известна аморфная же, но растворимая сера, получаемая, если к раствору многосернистого кальция CaS2 прилить соляной кислоты: CaS2 + 2HСІ = CaCl2 + Н2S+ S.
В жидком состоянии сера является точно так же в нескольких формах, смотря по температуре: при 114—160° она представляет легкоподвижную жидкость янтарно-желтого цвета, при 160° она начинает темнеть, а при 180° она становится почти черной, и ее нельзя вылить из сосуда, при 330° она, оставаясь черной, делается вновь подвижной, при 444,5° она кипит. По А. Смиту, жидкая сера представляет смесь двух изомеров Sa и Sb, находящихся в подвижном равновесии: Sa — более светлого цвета и подвижна, Sb — темная и тягучая. При низкой температуре преобладает Sa, при нагревании же увеличивается количество Sb; одни газы, как SO2 и НСІ, замедляют превращение, другие, например, аммиак, ускоряют. При затвердевании Sa получается кристаллическая, растворимая сера, Sb переходит в аморфную, нерастворимую серу. В газообразном состоянии она является также в различных формах. Если превратить серу в пар при 250° при низком давлении, то определение удельного веса ее паров показывает, что частица серы состоит из 8 атомов: При 450° и выше до 700°, судя по удельному весу, частица серы состоит из 6 атомов: S6. Выше 700° молекула серы является двухатомной: S2. Таким образом, сложная молекула серы при повышении температуры распадается на более простые — S2. Но вопрос о том, происходит ли распадение молекулы сразу на S2 (S8=4S2), или же при этом образуются промежуточные молекулы и S6 и S4 —является не вполне решенным. При понижении же температуры простые молекулы S2 опять соединяются в сложные. При нагревании паров серы до 2 000°, ее молекула распадается на отдельные атомы: S2 ↔ S+S.
Применение серы. Серу употребляют для производства серной кислоты (см.), для приготовления пороха, взрывчатых веществ, серных спичек, для окуривания хмеля, вина, для посыпания виноградников (во время болезни винограда), для приготовления сернистой кислоты, сернистого углерода, киновари, муссивного золота и других сернистых металлов, для вулканизации каучука и гуттаперчи и т. д.
Химические свойства серы. Сера соединяется как с металлами, так и с металлоидами, причем выделяется значительное количество тепла и света: так, сера горит в кислороде, в газообразном фторе. Такие металлы, как медь, цинк, железо и др., горят в парах серы
С водородом сера дает ряд соединений. При пропускании водорода над нагретой серой получается сероводород Н2S. Он образуется также при нагревании смеси парафинов с серой. В лабораториях его получают действием серной или соляной кислот на сернистое железо FeS или сернистую сурьму Sb2S3:FeS + 2НСІ = Н2S + FeCl2; Sb2S2 + 6HCl = 3Н2S +2 SbCl3.
Добывание ведется в тех же приборах, какие служат для добывания водорода (аппарат Киппа и т. п.). Сероводород — бесцветный газ, обладающий неприятным запахом тухлых яиц, сгущающийся при 74° в бесцветную жидкость, а при 85° застывающий в белое кристаллическое тело. Он находится в газах, выделяющихся при вулканических извержениях, и во многих минеральных водах. Очень ядовит. Примесь его к воздуху в размере 1/1500 действует смертельно для птиц, а в количестве 1/200 на млекопитающих. Лучшее средство противоядия – вдыхание небольшого количества хлора. Для этого можно смочить платок разведенной уксусной кислотой и вложить в него несколько кусочков белильной извести. Сероводород в воздухе может гореть, причем при свободном доступе воздуха он сгорает в воду и сернистый газ: 2H2S + 3O2 = 2H2O + 2SO2.
При ограниченном доступе воздуха происходит неполное сгорание, и выделяется сера: 2H2S + O2 = 2H2O + 2S. Этим пользуются в промышленности для извлечения серы из отбросов содового производства (по Леблану; см. XL, 14, 17): пропуская сероводород с вычисленным количеством воздуха над нагретой докрасна бурой железной рудой, получают свободную серу и воду. В воде сероводород хорошо растворяется: один объем воды растворяет 4,37 объема сероводорода при 0°, 3,58 объема — при 10° и 2,9 объема — при 20° Водный раствор H2S при хранении, особенно на свету, мутнеет вследствие того, что выделяется сера.
Водный раствор сероводорода обладает свойствами кислоты: окрашивает синюю лакмусовую бумажку в красный цвет, при действии его на соли различных металлов получаются сернистые металлы. Сернистые соединения (сульфиды) щелочных (K, Na и др.) и щелочноземельных (Са, Ва и Sr и т. п.) металлов в воде растворяются, сернистые соединения железа, марганца и т. п. металлов в воде не растворяются, но разлагаются в разведенных растворах кислот, сернистые же соединения меди, серебра, висмута и т. п. не разлагаются ни водой, ни разведенными кислотами. На этом свойстве сероводорода осаждать из солей сернистые соединения, отличающиеся различным цветом (например, сернистый цинк ZnS белого цвета, сернистый кадмий CdS желтого цвета, сернистая медь CuS черного и т. д.), основано его применение в аналитической химии (см.). Реакция, происходящая при взаимодействии между сероводородом и солями, например CuSO4, может быть выражена следующим уравнением: CuSO4 + Н2S = Н2SО4 + CuS. При действии сернистого водорода на едкое кали или едкий натрий получаются так называемые сульфгидраты KHS и NaHS: KOH + Н2S = KHS + Н2O.
Сернистый калий K2S (равным образом и сернистый натрий Na2S) получается при накаливании до красно-калильного жара смеси сернокислого калия K2SO4 (или Na2SO4) с углем. Раствор его можно получить, взявши раствор едкого кали, разделяя на две равные по объему части и насыщая одну часть сероводородом, пока последний поглощается. В этой части будет находиться сульфгидрат. Смешивая ее с другой частью раствора щелочи, получают в растворе сернистый калий K2S. При испарении раствора при низких температурах в разреженном пространстве, выделяются кристаллы K2S.5Н2O. При 150° они переходят в K2S.2Н2O, а при высшей t° — в K2S. Кроме сернистого калия K2S существуют полисульфиды: двух- K2S2, трех- K2S3, чeтыpex- K2S4 и пятисернистый калий K2S5. Наиболее постоянными являются K2S3, K2S4, K2S5. Получаются они при сплавлении едкого или сернистого кали с избытком серы в струе угольной кислоты: при 600° получается пятисернистый калий (в виде темно-бурой массы), при 800° он переходит в K2S4, а при 900° — в K2S3.
При сплавлении серы с поташом в закрытом тигле происходит выделение углекислого газа, и получается сплав бурого цвета печени, называемый серной печенью. Она получается также при кипячении раствора едкого кали с избытком серного цвета. Она содержит смесь полисульфидов с серноватисто-кислым калием K2S2O3, а также с сернокислым калием K2S2O4, если смесь была нагрета докрасна. Сернистые соединения натрия во многом близки с таковыми калия.
Сернистый аммоний (NH4)2S образуется при пропускании смеси Н2S с избытком аммиака через охлажденный до —18° сосуд. Получается бесцветное весьма летучее кристаллическое тело, неприятного запаха, сильно ядовитое и весьма непостоянное. На воздухе оно поглощает кислород, желтеет и содержит уже кислородные и многосернистые соединения. В воде оно хорошо растворяется, причем происходит отчасти его разложение: (NH4)2S + H2O = NH4OH + NH4HS. Водный раствор сернистого аммония получается при пропускании Н2S в раствор аммиака. Такой раствор хорошо растворяет серу и тогда содержит многосернистый аммоний. Из такого раствора были получены кристаллы пятисернистого аммония (NH4)2S2, плавящиеся при 40—50°.
Раствор сернистого аммония имеет широкое применение в аналитической химии (см. II, 552/53). Действуя на сернистое олово, мышьяк и сурьму, он их растворяет, причем образуются сульфосоли: (NH4)2 SnS3; (NH4)2 AsS3; (NH4)2 SbS3. Если мы сравним сульфосоли с соответствующими кислородными соединениями: оловянно-кислым (NH4)2SnО3, мышьяковокислым (NH4)3AsO4 и сурьмянокислым аммонием (NH4)3SbO4, то можно сказать, что сульфосоли происходят через замещение атомов кислорода в солях атомами серы.
Щелочноземельные металлы (Мg, Са, Sr и Ва) точно так, как калий и натрий, дают несколько соединений с серой; например, для кальция известны: CaS и CaS5. Многие сернистые соединения щелочноземельных металлов фосфоресцируют, иными словами — способны светиться в темноте после того, как были выставлены на свет.
При действии на растворы многосернистых металлов (натрия или кальция) соляной кислоты, происходит выделение сероводорода и осаждение серы: CaS5 + 2НСІ = CaCl2 + Н2S + 4S.
Если же поступить наоборот, т. е. в раствор соляной кислоты приливать раствор многосернистого кальция, то серы не выделяется, а на дно сосуда выпадает тяжелое маслообразное тело — пятисернистый водород, удельный вес 1,71 (СаS5 + 2НСІ = СаCl2 + Н2S5). .Он сохраняется без разложения только высушенный; в присутствии воды и особенно щелочей легко разлагается на сероводород и серу. При перегонке под уменьшенным давлением (40 мм, кипит при 68—85°), он разлагается, выделяя серу, и в приемнике собирается подвижная жидкость, по составу близкая к Н2S2.
При пропускании сероводорода в раствор хлора, брома и йода, образуются галоидоводородные кислоты, и выделяется сера: Н2S + R2 = 2НR + S, где R=Cl, Br, J.
Сероводород служит восстановителем, т. е. отнимает кислород от кислородных соединений, переводя их в низшие степени окисления. Так, например, соли окиси железа при действии сероводорода переходят в соли закиси: 2FeX3 + Н2S = 2HХ + S + FеХ2, где Х — кислотный остаток; соли мышьяковой кислоты переходят в соли мышьяковистой кислоты, и т. д. В щелочном растворе многие органические соединения Н2S переводит в соответствующие аминопроизводные (см. анилин). Крепкую серную кислоту он переводит в сернистую: H2SO4 + H2S = H2SO3 + H2O + S. Поэтому его нельзя сушить, пропуская через серную кислоту.
Галоидные соединения серы. При пропускании хлора над нагретым серным цветом получается хлористая сера S2Cl2, — темно-желтая, маслянистая жидкость удельный вес 1,7055, кипит при 138°. Дымит во влажном воздухе. В воде быстро тонет и затем разлагается. Хорошо растворяет свободную серу (до 66 весовых частей на 100), чем пользуются при вулканизации каучука. Однохлористая сера S2Cl2 получается как побочный продукт при добывании четыреххлористого углерода ССl4 действием хлора на сернистый углерод. При насыщении при 6°—10° S2Cl2 хлором получается двухлористая сера SCl2 — темно-бурая жидкость удельного веса 1,6, кипит при 64°, разлагаясь на хлор и S2Cl2. При насыщении при 22° двухлористой серы хлором, образуется подвижная, желтовато-бурая четыреххлористая сера SCl4 которая наполовину разлагается уже при 15°, а при 6° 97,57% ее превращается в SCl2 и Cl2. Четыреххлористая сера с хлористыми соединениями олова, золота образует кристаллические SnCl4.SCl4; AuCl3.SCl4. Водой все хлорные соединения серы разлагаются, причем образуются сернистый ангидрид и соляная кислота: 2S2Cl2 + 2H2O = 2SO2 + 4HCl + 2S; 2SCl2 + 2H2O = SO2 + S + 4HCl. Известны также бромистые, йодистые и фтористые соединения такого состава: S2Br2, SBr4; S2J2, SJ6 и SF6.
Из соединений с другими металлоидами опишем сернистый углерод CS2. Получается при пропускании паров серы через накаленный уголь. Бесцветная жидкость удельного веса 1,293, кипит при 48° замерзает при —116°. В обращении с ним нужно соблюдать большую осторожность, ибо он легко воспламеняется: достаточно поднести к нему нагретую стеклянную палочку, чтобы он загорелся. Легкая воспламеняемость происходит от того, что сернистый углерод — тело эндотермическое. При образовании его поглощается тепло. В воде растворяется плохо, но сам растворяет многие тела: сера, фосфор, йод, галоиды. На его способности растворять жиры основано его применение для извлечения масла из семян. Очень ядовит: мелкие животные, например, суслики, быстро погибают в атмосфере сероуглерода. Обладает антисептическими свойствами. С сернистыми щелочами образует тиоугольные соли: Na2S + CS2 = Na2CS2, аналогичные углекислым. При действии на эти соли слабых кислот в спиртовом растворе, получается непостоянная тиоугольная, или сульфоугольная кислота Н2СS3, легко распадающаяся на Н2S и СS2.
Промежуточное соединение COS — сернистая окись углерода — образуется взаимодействием окиси углерода СО с парами серы. Газ. Известно также соединение С3S2, аналогичное окислу О3S2. Оно получается из сернистого углерода и представляет красную жидкость, застывающую при —0,5°.
Кислородные соединения серы. Известны 4 окисла серы: сернистый газ (ангидрид) SО2, серный ангидрид SО3, надсерный ангидрид S2О7 и ангидрид водородо-сернистой кислоты S2О3. Из них наиболее важное значение имеют сернистый и серный ангидрид. Сернистый ангидрид получается при сгорании серы, а также при обжигании сернистых металлов, например, пирита FeS2: 4FeS2 +11О2 = 2Fe2О3 + 8SО2. Таким путем он получается в технике. В лабораторной практике он получается при действии концентрированной серной кислоты при нагревании на уголь, серу и многие металлы, например, медь, серебро и т. п.:
2H2SO4 + C = CO2 + 2SO2 + 2H2O;
2H2SO4 + S = 3SO2 + 2H2O;
2H2SO4 + Cu = 2H2O + CuSO4 + SO2.
В лаборатории чаще прибегают к действию крепкой серной кислоты на медь. Сернистый ангидрит — бесцветный газ, сгущающийся при —10° и застывающий при —76°. Критическая температура 155,4°, критическое давление — 78,9 атм. При испарении в быстром токе воздуха жидкого сернистого ангидрида температура понижается до — 50°. На этом основано его применение для получения низких температур. Жидкий сернистый ангидрид хорошо растворяет многие тела: йод, серу, фосфор, углеводороды, спирты, эфиры, кислоты, амиды, амины, минеральные кислоты. Благодаря исследованиям профессора П. И. Вальдена хорошо изучена электропроводность таких растворов, и разъяснены некоторые вопросы, касающиеся теории растворов. Сернистый ангидрид сильно растворяется в воде: 1 объем воды растворяет при 0° 79,821 объемов сернистого ангидрида, при 10° — 56,647 объемов, при 20° — 39,374 об. При охлаждении насыщенного при 0° раствора выделяются кристаллы гидрата SО2.7H2О. Водный раствор сернистого ангидрида пахнет и при кипячении может выделить весь сернистый ангидрид. При нагревании водного раствора сернистого ангидрида в запаянной трубке до 180°, образуется серная кислота и выделяется сера. Кислота состава Н2SО3 неизвестна, но соли, соответствующие такой кислоте (сульфиты), как то: кислый сернистокислый натрий (или калий) NaHSО3 (KHSО3) и средний сернистокислый натрий (или калий) Na2SО3 (K2SО3) и др. — получены. Соли представляют белые кристаллические тела. При действии на них кислот серной или соляной, из них выделяется сернистый газ:
Na2SO3 + H2SO4 = Na2SO4 + SO2 + H2O.
Сернистый ангидрид, равно как его растворы — обладают белящими и антисептическими (обеззараживающими) свойствами. При действии галоидов на сернистую кислоту образуется серная кислота и галоидоводородные кислоты:
x2 + H2SO3 + H2O = H2SO4 + 2Hx, где x=Cl, Br, J.
Таким образом, сернистая кислота служит антихлором, т. е. превращает свободный хлор в соляную кислоту. Сернистая кислота служит сильным восстановителем: высшие кислородные соединения она переводит в низшие, например, хромовый ангидрид СrО3, в окись хрома Сr2O3, и т. п.
При действии сероводорода на сернистый ангидрид выделяется сера и образуется вода: 2Н2S + SO2 = 2Н2О + 3S. Этой реакцией объясняется нахождение серы в почве вулканических местностей: как сероводород, так и сернистый газ входят в состав газов, извергаемых вулканами, и при их взаимодействии в почве образуется сера. Сернистый ангидрид вполне поглощается перекисями бария ВаО2 и свинца РbО3, образуя соли: PbО2 + SО2 = PbSО4. В некоторых случаях сернистый ангидрид раскисляется, уступая свой водород металлу; так, при пропускании SO2 в водный раствор хлористого олова SnCl2, получается осадок двусернистого олова SnS2 т. е. сернистый ангидрид переходит в сероводород, низшая степень окисления олова переходит в высшую. Интересное по свойствам вещество получается при действии водного раствора сернистого ангидрида на цинк: при этом водород не выделяется, а образуется цинковая соль очень нестойкой водородо-сернистой кислоты ZnS2O4.
Раствор ее желтого цвета и обладает очень сильными восстанавливающими свойствами: обесцвечивает индиго, из солей окиси меди выделяет красный осадок закиси меди или же металлической меди, из солей ртути и серебра — эти металлы. Желтая жидкость сильно поглощает кислород из воздуха, причем образуется соль сернистой кислоты. Натриевая соль водородистой кислоты выделена в виде кристаллов Nа2S2О4.2H2O. Свободная водородо-сернистая кислота H2S2O4 так непостоянна, что уже в растворе распадается на SО2 и S. Ангидридом ее будет окисел состава S2O3: H2S2О4 — H2O = S2O3. Окисел S2O3 получается при прибавлении небольшими порциями к расплавленному серному ангидриду сухого серного цвета при охлаждении не выше 12—15°. S2O3 осаждается на дне в виде синих капель, где и затвердевает: оставшийся расплавленный серный ангидрид сливают прочь. S2O3 разлагается при обыкновенной температуре: 2S2O3 = 3SО2 + S. Синий раствор в дымящейся серной кислоте буреет при разбавлении обыкновенной серной кислотой. При растворении в холодной воде происходит кипение, причем образуется серная, сернистая кислота и выделяется сера. Окисел S2O3 сообщает окраску дымящей серной кислоте, так как образуется при нагревании ее с серой.
Серный ангидрид SO3 образуется при горении серы наряду с SО2, но в незначительном количестве, ибо при высокой температуре он разлагается: SО3 = SО3 + О. Сернистый ангидрид получается при пропускании смеси кислорода и сернистого ангидрида над платиной, окисью железа, хрома и другими катализаторами. Этот контактный способ получения серного ангидрида разработан технически, и еще в 1900 г. на одном заводе известной фирмы Badische Anilin- u. Soda-Fabrik по этому способу было получено 116 000 тонн (7 000 000 пуд.) серной кислоты более дешево, чем по камерному способу. Катализатором при этом служит платинированный асбест, т. е. асбест, покрытый мелко раздробленной (подобно пыли) платиной. При этом необходимо принять меры, чтобы смесь газов SO2 и O2 была свободна от механических примесей, а также газообразных, ибо они (мышьяковистый ангидрид и др.) отравляют контактную массу и в короткое время делают ее совершенно непригодной. Наиболее благоприятная температура лежит между 400°—450°. При низших температурах реакция идет медленно, а при высших SO3 распадается на SO2 и О: при 400° соединяется 98%—99% газов, при 700° только 60%, а при 900° SO3 не образуется. Поэтому подогревание смеси необходимо только вначале, а потом может быть надобно даже охлаждение, если температура будет выше 400°. Для получения серной кислоты пары серного ангидрид пропускают в 97%—99% серную кислоту, концентрацию коей поддерживают постоянно благодаря определенному притоку воды (см. серная кислота, 566 сл.).
Серный ангидрид получается также при окислении сернистого ангидрида окислами азота, например азотноватым ангидридом (N2O4): 2SO2 + N2O4 = 2SO3 + 2NO при перегонке серной кислоты с фосфорным ангидридом: H2SO4 + P2O5 = SO3 + 2HPO3; при обжигании железного купороса.
Серный ангидрид представляет длинные, прозрачные бесцветные призмы, плавящиеся при 14,8° в маслянистую жидкость, кипит при 46°. Определение плотности пара серного ангидрида показывает, что молекула его SО3, но это форма нестойкая, ибо при обыкновенной температуре, особенно в присутствии малейших следов серной кислоты, быстро происходит уплотнение (полимеризация), и получается белая масса из шелковистых, блестящих белых игл, которые остаются твердыми до 50°С, а выше этой температуры переходят в пары. В продажу он поступает в виде полимерного окисла S2O6. При действии на серный ангидрид получается серная кислота. При этой реакции выделяется 21,8 больших калорий.
Серная кислота представляет густую маслообразную жидкость удельного веса 1,85 при 0°. В практике она носит название купоросного масла. Чистая серная кислота, получающаяся через вымораживание, соответствующая формуле Н2SO4, застывает при 10,5°, кипит при 838°, причем разлагается на серный ангидрид и воду, которые при охлаждении вновь соединяются в серную кислоту. С водой она жадно соединяется, отчего продажная серная кислота не вполне соответствует формуле Н2SO4 и содержит в себе больший или меньший избыток воды. Соединяясь во всех отношениях с водой, серная кислота выделяет большое количество тепла, которое может быть вычислено по следующей эмпирической формуле:
Q = n/(n+1,7983) 17,86 больших калорий,
где Q есть количество тепла, а n — число граммолекул воды, приходящихся на одну граммолекулу серной кислоты. Из этой формулы видно, что при бесконечно большом количестве воды Q не превысит 17,86 больших калорий.
При смешении же серной кислоты со льдом (снегом) получается понижение температуры. Если серную кислоту предварительно разбавить объемом воды и полученный раствор охладить до 0°, а затем смешать со снегом (1 часть раствора с 2-мя частями снега), то температура смеси понизится до —33°. При смешении серной кислоты с водой происходит не только выделение тепла, но и сжатие; так, при смешении равных объемов это сжатие достигает 3%; из 50 куб. см. Н2SO4 и 50 куб. см. воды получается только 97,1 куб. см раствора.
Удельный вес растворов серной кислоты, равно как и температура их замерзания, были исследованы рядом ученых.
Обстоятельные исследования Д. И. Менделеева над удельными весами растворов серной кислоты заставляют предполагать существование в растворах различных гидратов серной кислоты; гидраты эти суть:
1) Н2SO4.H2O — температура плавления +8,5°;
2) Н2SO4.2H2O — температура плавления около —70°;
3) Н2SO4.4H2O — температура плавления —24,5°;
4) Н2SO4.6H2O и пр.
На существование гидратов в растворах указывают наблюдения над температурой замерзания.
На способности серной кислоты отнимать воду основано ее употребление для сушки газов. При действии серной кислоты на органические тела: кожу, дерево, сахар и т. п., последние обугливаются, так как серная кислота отнимает от них элементы воды. Если фильтровальную бумагу погрузить на полминуты в 78%-ный раствор серной кислоты и затем, тщательно промыв слабым раствором аммиака, высушить, то получается так называемый растительный пергамент.
По отношению к серной кислоте металлы могут быть разделены на две группы; к первой принадлежат: серебро, ртуть, медь, свинец и висмут, на которые действует концентрированная и нагретая кислота, причем образуется соответствующая соль и выделяется сернистый ангидрид (см. выше уравнение реакции меди и серной кислоты); ко второй группе относятся: марганец, никель, кобальт, железо, цинк, кадмий, алюминий, олово, таллий, щелочноземельные и щелочные металлы, реагирующие с серной кислотой при всякой ее концентрации, причем при низкой температуре выделяется водород, а при высокой температуре (и при значительной концентрации) одновременно с водородом и сернистый ангидрид.
Соли серной кислоты (сульфаты), за исключением SrSO4, BaSO4, CaSO4 и PbSO4, хорошо растворяются в воде. Серная кислота — двухосновная: способна давать с щелочами два ряда солей — кислые, например, NaHSO4 и KHSO4, и средние: Na2SO4 и K2SO4.
Сернокислые соли: железа FeSO4.7H2O, цинка ZnSO4.7H2O и меди CuSO4.5H2O, носят название купоросов. Квасцами называют соли состава R2M2(SO4)4.24H2O, где R = Na, K, NH4, а М = Fe, Сr, AІ.
Дымящая серная, или нордгаузенская, кислота (пиросерная) H2S2O7 получается при растворении серного ангидрида в серной кислоте. Добывают ее, накаливая железный купорос FeSO4.7H2O. Сперва из него выделяется вода, и он отчасти окисляется: 2FeSO4 + О = Fe2S2O9.
При дальнейшем накаливании соединение Fe2S2O9 разлагается на окись железа Fe2O3 и серный ангидрид, пары которого проводят в небольшое количество воды или серной кислоты Fe2S2O9 = Fe2O3 + 2SO3; 2SO3 + H2O = H2S2O7.
При обыкновенной температуре пиросерная кислота представляет кристаллическое тело, плавящееся при 35°. На воду, дерево, органические тела и т. п. она действует энергичнее серной кислоты.
Надсерный ангидрид S2O7 получается при действии тихого разряда на смесь равных объемов сернистого ангидрида и кислорода, в виде маслянистой жидкости, застывающей при 0° в кристаллы, легко разлагающиеся. Он обладает сильными окислительными свойствами: выделяет иод из йодистого калия, обесцвечивает индиго и т. д. Растворяясь в воде, образует надсерную кислоту Н2S2O8.
Надсерная кислота Н2S2O8 образуется при электролизе 40% — 50%-ной серной кислоты около анода, если последний хорошо охлаждать и плотность тока будет значительной. Таким образом, технически получаются надсерно-кислый аммоний или калий, выделяющиеся в виде кристаллов при электролизе насыщенных растворов сернокислого аммония или калия.
Раствор надсернокислого калия в серной кислоте называется кислотой Каро. Он содержит, вероятно, кислоту состава Н2SО3, так как раствор с теми же свойствами получается при смешении серной кислоты с перекисью водорода: H2SO4 + H2O = H2SO5 + H2O. Обладает сильными окислительными свойствами: из йодистого калия выделяет иод, из растворов солей серебра, меди, марганца, кобальта и никеля — высшие окислы этих металлов.
Сера образует еще следующие кислоты:
Серноватистую H2S2O3
Дитионовую H2S2O6
Тритионовую H2S3O6
Тетратионовую H2S4O6
Пентатионовую H2S5O6
Гексатионовую H2S6O6
Серноватистая кислота известна в виде солей, из коих самая распространенная — гипосульфит, или серноватистокислый натрий Na2S2O3, получается при нагревании раствора сернистокислого натрия с серным цветом: Na2SO3 + S = Na2S2O3. Он представляет большие, бесцветные, легко растворимые кристаллы. Имеет широкое применение в фотографии. Употребляется как антихлор: при действии на него хлора получается сернокислый натрий, соляная кислота, и выделяется сера: Na2S2O3 + Cl2 + H2O = Na2SO4 + 2HCl + S. Иод действует иначе: получается тетратионовокислый натрий Na2S2O6 и йодистый натрий: 2Na2S2O3 + J2 = 2NaJ + Na2S4O6. При действии кислот выделившаяся серноватистая кислота распадается на SO2 и S: Na2S2O3 + 2НCl = 2 NaCl + Н2O + SO2 + S. Соли дитионовой кислоты обыкновенно получаются при пропускании ее в воду, в которой находится во взвешенном состоянии свежеосажденный гидрат перекиси марганца или же гидрат окиси железа: 2Fe(ОН)3 + 3SO2 = FeS2О6 + FeSО3 + 3Н2О. Действуя раствором гидрата бария, получают бариевую соль, разлагая которую разведенной серной кислотой, получают свободную кислоту Н2S2O6. Выпаривая в вакууме, сгущают раствор до удельного веса 1,35. При дальнейшем выпаривании она распадается на серную и сернистую кислоту.
Тритионовокислый калий получается при действии SO, на раствор серноватистокислого калия: 2K2S2O3 + 3SO2 = 2K2S3O6 + S. Натриевая соль может быть получена при действии иода на смесь серноватистокислого и сернистокислого натрия: Na2S2O2 + Na2SO3 + J2 = 2NaJ + Na2S3O6.
Получение тетратионовокислого натрия см. выше. Пента - Н2S5O6 и гексатионовая кислота Н2S6O6, получаются при пропускании сероводорода в почти насыщенный раствор сернистого ангидрида при 0° (жидкость Вакенродера). После двухдневного стояния в закрытом сосуде повторяют пропускание сероводорода несколько раз до полного исчезновения сернистого ангидрида. При этом происходит ряд сложных реакций, и в растворе находятся: коллоидальная сера (по Спрингу, S8.Н2О), три-, тетра-, пента- и гексатионовая кислота. Свободные тионовые кислоты известны только в растворе.
Хлорангидриды серной кислоты. Хлористый сульфурил SO2Cl2 получается при соединении SO2 и хлора Cl2 под действием прямых солнечных лучей или же в присутствии камфары. Бесцветная жидкость, кипит при 69°, удельный вес 1,6674. При действии небольшого количества воды образует хлорсульфоновую кислоту SO2(ОН)СІ и соляную кислоту: SO2Cl2 + H2O = SO2(OH)Cl + HCl, с избытком же воды — серную и соляную кислоту: SO2Cl2 + 2H2O = H2SO4 + 2НСІ.
Интересен фтористый сульфурил SO2F2 получающийся при прямом действии SO2 и фтора F2. Очень стойкое тело: бесцветный газ, сгущающийся при —52°, затвердевающий при —120°. С водой может быть нагрет без разложения в запаянной трубке до 150°, щелочи действуют на него медленно, натрий в нем плавится, не теряя металлического блеска.
И. Каблуков.
Сера в медицине употребляется внутрь как нежное слабительное и, между прочим, входит в состав сложного лакричного порошка. Такое действие серы основано на том, что сера в щелочном содержимом кишок превращается в сульфгидрат натрия; это соединение усиливает перистальтику кишок; а так как указанное превращение серы происходит медленно, то и послабляющее действие сравнительно слабое. Длительное употребление серы, как слабительного, может вызвать хронический катар кишок; надо, однако, сказать, что это относится в той или иной степени ко всем слабительным.
Кроме того, сера употребляется наружно при различных кожных заболеваниях (чесотка, экземы и пр.), входя в состав различных мазей; вероятно, и здесь действует не сама сера, а образующаяся в мази сернистая щелочь.
В последнее время стали употреблять серу во взмученном состоянии подкожно или внутримышечно («парентерально», т. е. минуя желудочно-кишечный канал) при различных заболеваниях (хронический ревматизм суставов, хроническое воспаление седалищного нерва, хронический выпотной плеврит и пр.). Действие серы в таких случаях сводится, по-видимому, к повышению обмена веществ, в особенности обмена белков, солей и воды; кроме того, сера действует на печень, усиливая ее функцию, функция же печени тесно связана с обменом веществ. Такое действие серы в значительной степени сходно с действием белков, вводимых под кожу или в мышцы (протеинотерапия). Сера для подкожных или внутримышечных впрыскиваний употребляется во взвешенном состоянии в масле или в желатине; взвесь в масле, однако, вызывает значительную боль и трудно всасывается; взвесь же в желатине вызывает незначительную болезненность и всасывается раз в пять скорее; вводят по 0,2—0,5 куб. см взвеси каждый раз.
До сих пор действие серных ванн было неизвестно, серные ванны (содержащие сернистую щелочь и сероводород) употреблялись при различных заболеваниях чисто эмпирически. Но, вероятно, и здесь имеем такое же действие серы, как и при подкожном впрыскивании: сера парентерально поступает в организм и усиливает обмен веществ. Серные ванны издавна употреблялись при тех же заболеваниях, при которых теперь употребляется подкожное и внутримышечное введение серы.
Н. Кабанов.
| Номер тома | 41 (часть 6) |
| Номер (-а) страницы | 545 |
