Сода
Сода (угленатриевая соль, углекислый натрий). В безводном состоянии, угленатриевая соль Na2CО3, представляет собой белый, непрозрачный порошок, удельного веса 2,4—2,5, с точкой плавления при 853°, при долгом прокаливании немного разлагается, теряя до 1,3% в весе (улетучивается углекислота); растворяется в воде: наибольшая растворимость при 38°С; смотря по температуре, из водных растворов кристаллизуется Na2CO3 с 1, 2, 3, 5, б, 7, 10 и 15 молекулами воды. Водные растворы соды имеют щелочную реакцию: окрашивают красную лакмусовую бумажку в синий цвет; при действии кислот на соду и ее растворы, выделяется углекислота и образуются соли соответственных кислот; при смешивании растворов соды с растворами солей некоторых металлов (например, калия, магния, бария и т. д.), образуются осадки углекислых солей этих металлов. В продаже различают несколько сортов соды, имеющих техническое значение. Кальцинированную (прокаленную) соду 1-го сорта с содержанием 98—99% Na2CO3; кальцинированную соду 2-го сорта, содержащую больше 2% посторонних примесей; эта соды находит применение в мыловаренном производстве: кристаллическую соду Na2СО3. 10H2O, содержащую до 63% воды: она образует моноклинические прозрачные кристаллы удельным весом 1,42—1,475, плавящиеся при 34° в кристаллизационной воде; эта сода находит применение в прачечных заведениях для стирки белья; двууглекислую соду, NaHCO3, представляющую собой белый кристаллический порошок, трудно растворимый в холодной воде; этот сорт приготовляется из кристаллической, насыщением ее углекислотой; находит он применение в медицине; каустическую соду, NaHO, в виде сплавленной белой массы, хорошо растворимой в воде, приготовляемой из соды действием едкой извести; каустическая сода находит применение в мыловаренном производстве, при очистке минеральных масел, при приготовлении многих натровых солей и т. п.
Рис. 1.
Добывание соды. 1) Натуральная сода встречается в воде многих минеральных источников и в так называемых натровых озерах (например в Египте, Армении, Северной Америке и пр.), в твердом виде в минералах разного названия (трона, урао, термонатрит) и в выцветах на почве в смеси с другими солями (NaCl, Na2SО4). Добывание соды из озерных вод практикуется в некоторых странах и до сего времени (например, в Египте, в Соединенных Штатах); но количество добываемой так соды очень незначительно.

Рис. 2.
2. В золе приморских и степных растений содержится сода, иногда в довольно значительных количествах. До открытия искусственного получения соды, из золы таких растений добывали соду в Испании, на юге Франции и т. п. В настоящее время это источник получения соды уступил место искусственному ее получению на химических заводах.

Рис. 3.
3. Добывание соды в технике практикуется по двум способам: а) сульфатному или Леблановскому (названному так по фамилии изобретателя — француза Ник. Леблана) и б) аммиачному, предложенному Дайаром и Геммингом и технически разработанному бельгийцем Сольве. Способ Леблана сводится к следующей операции: безводный сульфат или серно-натровая соль сплавляется с углем и мелом (известняком) на поду пламенной печи; при сплавлении получается сплав содержащий соду (Na2CO3), немного Na2О, Na2S3, СаS, СаО, избыток угля и мела (известняка). Реакции, которые происходят при сплавлении, можно представить так: 1) сернонатриевая соль восстановляется на счет угля в сернистый натрий: Na2SО4 + 2С = Na2S + 2CO2; углекислота улетучивается, как газ. 2) Сернистый натрий вступает, в обменное разложение с углекальциевой солью, составляющей мел или известняк; образуется угленатриевая соль и сернистый кальций: Na2S + CaCO3 = Na2CO3 + CaS; 3) Избыток известняка с углем дает окись кальция и окись углерода: CaCО3 + С = CaО + 2СО; окись углерода, выделяющаяся из расплавленной массы, тотчас же сгорает. Сырые материалы для добывания соды по этому способу: прокаленный сульфат или безводная серно-натриевая соль; древесный или каменный уголь и мел (или известняк). Сырые материалы должны быть для плавки подготовлены: сульфат в виде порошка; уголь измельчен в порошок; каменный уголь выбирается с меньшим содержанием золы и измельчается; мел или известняк дробится до величины ореха. Материалы отвешиваются в надлежащих количествах, тщательно смешиваются и загружаются на под пламенной печи. Весовые количества сырых материалов: 100 весовых частей сульфата, 112—120 в. ч. мела (известняка) и 42—46 в. ч. угля, смотря по качеству его. Как уже было выше упомянуто, плавка соды производится на поду пламенной печи. Рис. 1 изображает продольный разрез английской пламенной печи, рис. 2 — разрез ее по поду и упарной коробке. Рис. 3. Общий вид печи. Топка с колосниковой решеткой b для сжигания топлива отделена от плавильного пода порогом с. Два рабочих пода i и h; верхний i служит для предварительного прогревания внесенной в печь смеси для плавки, h — нижний под, на котором и производится самая плавка. Материалы засыпаются на под i при помощи воронки k. Дверки m служат для перемешивания сплава и его выгребания. Отработавшие печные газы проходят над упарной коробкой р, склепанной из железные листов; в этой коробке упариваются содовые щелока до начала кристаллизации; железная коробка, с дырчатым двойным дном w, служит для отделения кристаллов от маточного раствора. Прейдя над коробкой р, печные газы удаляются в боров D, а затем в дымовую трубу. Печь изнутри выложена огнеупорным кирпичом. Смесь материалов, предназначенных для плавки, засыпают при помощи воронки k на верхний под и для предварительного нагревания, потом ее перегребают на нижний под h, где она плавится. Все время приходится массу перемешивать. В начале плавки, когда вся масса придет в огненно-жидкое состояние, на ее поверхности появляются пузыри газа; огненно-жидкая масса кипит, это выделяется углекислота; при дальнейшем нагревании, когда большая часть образовавшегося Na2S прореагирует, т. о. превратится в соду, огненно-жидкая масса начинает густеть; на ее поверхности появляются огненные языки: это горит окись углерода. Густение массы и появление огненных языков — признаки, указывающие на то, что плав готов для выгреба. Тогда рабочие подкатывают к рабочему отверстию m железную каретку и выгребают в нее огненно-жидкую массу с пода особыми железными скреблами; в каретке сплав застывает в твердую массу. Цвет правильно приготовленного плава — печеночно- или желто-бурый с поверхности; серый внутри, с пористо-пемзообразным строением. Если едкий натр перечислить на Na2CO3 то сырая сода состоит из 36—45% Na2CO3 и переменна от количества CaS, Са2О, CaCO3 и угля. Самая тяжелая сторона содовой плавки на поду пламенной печи указанного устройства - ручная работа перемешивания плава; для уменьшения этой операции предложены механические вращающиеся печи револьверного типа. Рис. 4 изображает внешний вид такой печи; рис. 5 — продольный разрез ее. Неподвижная топка с колосниковой решеткой а для сжигания топлива; чрез шейку с и глазок b пламенные газы вступают в цилиндр c, в котором происходит плавка материалов; цилиндр изготовляется из толстых железных листов и выкладывается изнутри огнеупорным кирпичом. Сырые материалы загружаются чрез лаз t, когда цилиндр вращением повернут так, чтобы лаз был обращен вверх; когда же плав готов и его надо удалить из цилиндра, цилиндр повертывается так, чтобы лаз был обращен вниз. Для вращения цилиндра на окружности его, у заднего конца, находится зубчатое колесо m, зацепляющее за малое колесо, расположенное внизу и приводимое в движение небольшой паровой машиной, тут же поставленной. Для наблюдения за плавкой, на покатой части печи n имеются окна, закрытые слюдяными стеклами: чрез них можно наблюдать внутренность цилиндра. Отработавшие печные газы проходят над двумя упарными коробками р и p’ в которых упариваются содовые щелока до кристаллизации, и удаляются в дымовые каналы qq. Так как плавка происходит во вращающемся цилиндре, то ручная работа перемешивания совершенно устраняется. Полученный сплав, после остывания, подвергается измельчению до величины кусков в кулак и выщелачиванию водой. При этом в водный раствор переходит все то, что способно раствориться: главным образом сода, едкий натр, сернистый натр и пр.; нерастворимая часть состоит из частиц угля, мела (углекислого кальция), сернистого кальция и пр. Для того, чтобы получить насыщенный раствор в короткое по возможности время, выщелачивание производят в особого рода аппаратах, которые дают возможность производить операцию методически, причем получаются крепкие щелока сначала крепостью в 32—30°Б., а потом в 27°Б. Полученные щелока поступают на упаривание в выпарные коробки; упаривание продолжают до тех пор, пока из жидкости не будут выпадать растворимые соли в виде мелких кристаллов. Для уменьшения топлива на упаривание упарные коробки, в которых производится операция, прогреваются отходящими пламенными газами (см. рис. 1, 2 и 5). Когда раствор доведен до кашицеобразного состояния, его выпускают из выпарной коробки в коробку, расположенную рядом с выпарной и снабженную дырчатым дном; на последнем кристаллы солей задерживаются, маточный же раствор отфильтровывается и скопляется под ним. Кристаллы с дырчатого дна сгребают и подвергают прокаливанию для удаления воды и органических веществ. Прокаливание производится на поду особой пламенной печи; получают содовую соль или кальцинированную соду 2-го сорта, с содержанием 90—97% Na2СO3; для получения из нее более чистой кальцинированной соды 1-го сорта, ее подвергают рафинированию, для этого растворяют ее до получения в горячем виде растворов крепостью в 30—31,5°Б., переводят растворы в железные кристаллизаторы, где дают им кристаллизоваться; выкристаллизовывается сода состава Na2CO3.10Н2О. Кристаллическая сода довольно чиста и сама по себе находит употребление в домашнем хозяйстве и в прачечных заведениях при стирке белья; для получения рафинированной соды жидкости в 30—31,5°Б. дают время отстояться; прозрачный раствор переводят в выпарную коробку, где он упаривается до тестообразной консистенции; затем кристаллы отфильтровываются и подвергаются прокаливанию. Маточные растворы, полученные при первой кристаллизации, всегда содержат, кроме Na2CO3, некоторое количество едкого натра и других солей, от содержания органических веществ и сульфосолей железа они бывают окрашены в красный цвет, отчего и называются красными щелоками. Красные щелока находят выгодным переделывать не в соду, а в едкий натр; для этого они смешиваются с некоторым количеством извести, нагреваются, отфильтровываются от осадка и выпариваются в железных или чугунных гренах до такой консистенции, чтобы при остывании масса имела твердый вид. Во время выпаривания вычерпывают посторонние соли, которые выделяются на дне котла; для осветления же и окисления органических веществ прибавляют некоторое количество чилийской селитры. В результате получают желтоватую каустическую соду, которая дешевле белой. Она поступает на мыловаренные и другие заводы, где не требуется едкой щелочи высокого качества. Таково получение соды по способу Леблана.

Рис. 4. Рис. 5.
Аммиачный способ добывания соды основан на том, что двууглеаммониевая соль с хлористым натрием в одном растворе на холоду разлагается на хлористый аммоний и двуугленатриевую соль по равенству:
(NH4)HCO3 + NaCl = NH4Cl + NaHCO3
причем двуугленатриевая соль, как малорастворимая в присутствии хлористого аммония, выделяется в виде осадка. Лабораторно этот способ сводится к следующим операциям: приготовляется раствор поваренной соли, содержащий 26—27 г NaCI в 100 куб. см, насыщается аммиачным газом, так чтобы последнего растворилось в жидкости около 7—6 г; через подготовленный так раствор пропускается струя углекислоты; тогда растворенные в жидкости вещества вступают во взаимодействие, в результате которого из раствора выделяется малорастворимая NaHCO3. Кажущееся столь простым с химической стороны добывание соды по этому способу при перенесении его в заводскую обстановку требует соблюдения многих условий со стороны концентрации и температур, а также применения сложных железных аппаратов, вполне герметичных для уменьшения утечки NH3 и СО2 и допускающих производить вышеуказанные операции в большом масштабе и беспрерывно удалять из круга действия выделяющееся твердое вещество (NaHCO3), с отделением его во время хода самой операции от маточного раствора, содержащего NH4Сl. Кроме аппаратов, имеющих непосредственнее назначение-получение NaHCO3 и превращение этой соли в Na2CO3, должны быть в ходу в производстве также аппараты добывающие NH3, из маточных растворов, содержащих NH4Сl и аппараты, в которых разлагается NaHCO3 и СаСО3 для получения углекислоты (СО2, требуемой для образования НаСО3.
Аммиачный способ получения соды состоит из следующих операций:
1. Приготовления раствора хлористого натрия.
2. Насыщения его аммиачным газом с дальнейшей фильтрацией раствора.
3. Насыщения приготовленного раствора углекислотой.
4. Отфильтровывания выделившейся двууглекислой соды от засевшего в кристаллах маточного раствора и промывка его.
5. Прокаливания двууглекислой соды для получения соды (Na2CO3).
6. Извлечения из маточного раствора углекислоты и аммиака.
7. Обжигания известняков с целью добывания извести, служащей для выявления аммиака из нашатыря и углекислоты, которая заменяет углекислоту, уходящую с завода в виде соды.
Для получения крепкого, насыщенного раствора хлористого натрия в заводах пользуются природными солеными растворами, добываемыми из земли при помощи насосов; если природные рассолы не имеют надлежащей крепости, то их донасыщают поваренной солью, какая имеется под руками. Так как при насыщении растворов аммиаком выделяется тепло, то рассолы охлаждают. В аппарате Сольвея (рис. 6) для этого служит змеевик (S), погруженный в жидкость; по змеевику течет холодная вода. Сосуды делаются из луженой жести или из свинца с деревянной обшивкой. Сосуды снабжаются мешалками (W), которые находятся в непрерывном движении во время пропускания аммиака. Для того, чтобы змеевик с холодной водой не препятствовал движению мешалок, сосуд, в который впускается непосредственно аммиак, не имеет мешалки, но этот сосуд сообщается с другими сосудами посредством труб, идущих вверху и внизу. Когда пропускание аммиака закончено, останавливают мешалки и дают собраться на дно осадку, состоящему из магнезии и углекислой извести. Для лучшего выделения осадка переводят жидкость в высокий и довольно узкий сосуд (D), оканчивающийся внизу конусом, в вершине коего и собирается рыхлый осадок, который выпускают чрез имеющийся внизу сосуда клапан.
Насыщение аммиачно-соляного раствора (предварительно охлажденного) углекислотой производят в башнях Сольвея (называемых также абсорберами, рис. 7.). Они имеют от 11 до 16 метров высоты. Наполняются они до двух третей аммиачно-соляным раствором. Башни разделяются на много отделений горизонтальными перегородками с широким отверстием посредине. Над каждой перегородкой поставлен низкий решетчатый сегмент шара. Внизу сбоку башни начинается труба, отводящая жидкость по насыщении последней углекислотой в помещение с фильтрами (Z). Фильтры представляют вертикальные цилиндры около 1 м в диаметре и такой же высоты, они имеют решетчатое дно, которое покрывается холстом и войлоком. Снизу отсасывают маточный раствор насосом и направляют его в регенератор аммиака.
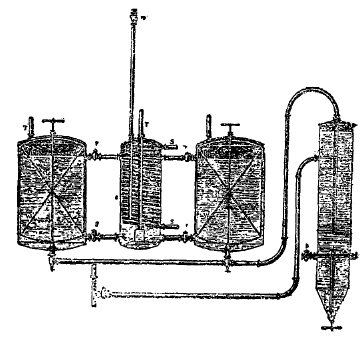
Рис. 6.
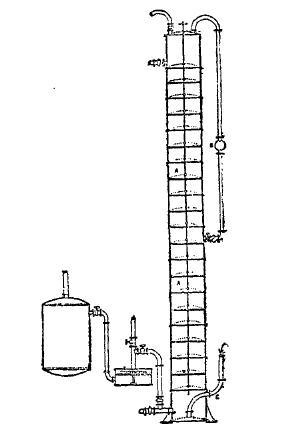
Рис. 7. Башня Сольвея (поперечный разрез) АА — Башня, Е – труба, приводящая газ. Z – фильтры. V – труба к воздушному насосу.
Требуемая для поглощения углекислота добывается прокаливанием известняков и двууглекислой соды. Прокаливание известняков производится в шахтных печах, в которые известняковой камень забрасывается вместе с коксом; выделяющиеся при обжигании газы, содержащие 30—33%, углекислоты по объему, при помощи насоса выкачиваются из шахтной печи, пропускаются через водяную промывалку и подаются в поглотители. Фильтрование содержимого поглотителей лучше всего удается при помощи фильтров с отсасыванием; это круглые железные ящики, снабженные фильтрующим дном; пространство под последним соединено с высасывающим насосом. Прокаливание двууглекислой соды производится в особого рода калильных печах, закрытых и снабженных отводной трубой для удаления аммиака, углекислоты и паров воды. Для того, чтобы прокаливаемая сода равномерно прогревалась и не приставала к стенкам, печь снабжается механической мешалкой.
Отжатый на фильтрах с отсасыванием щелок, содержащий нашатырь, отчасти двууглекислый натрий или аммоний и избыток поваренной соли, поступает в перегонный железный котел, где смешивается с известковым молоком и нагревается открытым паром до кипения. Таких перегонных котлов в батарее устанавливается 3 и более; работают они так: аммиачный газ с водяными парами из 1-го котла проходит во 2-й, отсюда в 3-й и т. д.; жидкость в последних доводится до кипения и аммиак удаляется.
Выходы: на 100 весовых частей кальцинированной аммиачной соды, вместо теоретических 110 в. ч. NaCI расходуют 130-200 в. ч. поваренной соли с, 95%-ным содержанием, так что выходы соды составляют 55—65% от поваренной соли. Расход на 100 в. ч. аммиачной соды в сырых материалах: 180—200 в. ч. NaCl; 85—115 в. ч. угля; 15 — кокса; 110—160 — известняка и 1 в. ч. сернокислого аммиака. Аммиачная прокаленная сода получается с содержанием 98—99% Na2CO3; 1—0,5% NaCl; 0,2 — Na2SO4; остальное до 100 – вода. Эта сода всегда рыхлее Леблановской.
Мировая добыча соды в 1904 г. по Осту достигла 1,5 миллионов тонн и распределялась так:
Англия - -
Германия – 325 000 т;
Франция – 175 000 т;
Австро-Венгрия – 100 000 т;
Россия – 82 000 т;
Бельгия – 32 000 т;
САСШ – 120 000 т.
Мировое производство соды в 1908 г. достигло до 2 миллионов тонн; из них около 550 000 т приходится на соду, добываемую по способу Леблана (Dammor). Употребления соды многочисленны и разнообразны: для приготовления стекла, едкого натра, металлического натрия и различных натровых солей. Много соды употребляется при отбеливании хлопчатобумажных и льняных тканей, при извлечении жира из шерсти, при валянии сукон и в домашнем быту при стирке белья и мытье полов; в писчебумажном деле, иногда при крашении и ситцепечатании; в медицине и в химических лабораториях.
Литература: Любавин, «Техническая химия», 2-й т. (1899 г.); Федотьев, «Содовое дело и связанные с ним производства» (1898).
Е. Орлов.
| Номер тома | 40 |
| Номер (-а) страницы | 12 |
