Спиртокислоты
Спиртокислоты (или окси-кислоты) представляют обширный класс соединений двойственного химического характера (характер функции), проявляя свойства кислот и спиртов — собственно спиртокислоты, или кислот и фенолов — фенолокислоты. Обширный класс этих соединений разделяется по различным признакам на отдельные группы.
Кроме основности и атомности, по которым группируют оксикислоты, большое значение имеет относительное положение спиртового водного остатка и карбоксила; на основании этого признака различают α, β, γ, δ и т. д. оксикислоты; причем порядок букв указывает, при каком атоме углерода, начиная с соседнего к карбоксилу, обозначаемого расположен спиртовой водный остаток.
Относительное расположение водного остатка и карбоксила сказывается на различии степени кислотности (α-кислоты несколько более сильные кислоты) и особенно на реакциях выделения воды из оксикислот — образовании ангидридов. Наконец, по характеру спиртовых водных остатков различают первичные оксикислоты (с группой СН2ОН), вторичные (с группой СНОН) и третичные (с группой СОН). Различие оксикислот на основании этого признака особенно сказывается на поведении их при окислении, вполне аналогичном спиртам.
Оксикислоты жирного ряда представляют или густоватые жидкости, или твердые кристаллические тела растворимые в воде и спирте и некоторые в эфире. Обычно неспособны перегоняться без разложения. Вкус оксикислот обычно менее резкий, чем у других кислот, и часто приятный (молочная, яблочная, лимонная, виннокаменная и некоторые другие). Заключая один или несколько ассиметрических атомов углерода, способны являться в виде оптически деятельных изомеров. Благодаря этому и способности к кристаллизации кислот или солей их они послужили опытным материалом, на котором развилось учение о расположении атомов в пространстве — стереохимия, и разработаны были методы разделения оптически недеятельных форм (рацемоты) на оптически деятельные изомеры (Пастер, Вант-Гофф, Вислиценус и др.).
Весьма часто оксикислоты или являются в результате брожения, особенно углеводов — молочная кислота, или сами могут подвергаться процессам брожения. Многоатомные сложные онсикислоты получаются при окислении многоатомных спиртов и углеводов и могут служить для их характеристики (глюконовая, сахарная, слизевая), а также при окислении непредельных кислот, входящих в состав высыхающих масел — реакция, которой пользуются при изучении природы непредельных кислот, входящих в состав жиров. Многие представители оксикислот распространены в растениях, а некоторые и в животных, и стоят в связи с аминокислотами, представляя связующее звено между углеводами и белками.
Фенолокислоты распространены обычно в виде эфиров или других производных в растениях. Могут получаться и искусственно общими способами введения гидроксила в ароматические кислоты или карбоксильной группы в фонолы; последняя реакция имеет техническое значение при приготовлении салициловой кислоты
![]()
из фенолята и угольного ангидрида. Присоединение СО2 к многоатомным фенолам протекает еще легче (при нагревании в водном растворе фенолов с угле-аммонийной солью). Из других фенолокислот представляет интерес протокатеховая
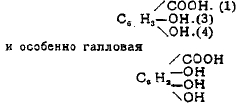
стоящая в близком отношении к пирогаллолу и, что особенно важно, к танину, важнейшему представителю группы дубильных веществ, имеющих большое техническое значение (дубление, чернила и пр.). Для выяснения природы дубильных веществ большое значение имеют работы покойного Э. Фишера об ангидридах фенолокислот, названных им депсидами по аналогии с пептидами. Он выработал общие приемы получения депсидов и получил некоторые из них, оказавшиеся тождественными с природными дубильными веществами.
Многие фенолокислоты (салициловая, галловая и другие) находят широкое применение в жизни (в качестве лекарств, антисептиков) и технике.
Н. Демьянов.
| Номер тома | 41 (часть 4) |
| Номер (-а) страницы | 162 |
