Сплавы (химические)
Сплавы (химические). Расплавленные металлы обладают способностью растворяться друг в друге, и когда полученные растворы отвердеют, то получаются различные сплавы. Сплавы имеют более широкое применение, чем чистые металлы, ибо обладают такими свойствами, благодаря которым являются пригодными для различных технических целей. Несмотря на то, что изучением сплавов ученые интересовались давно, только благодаря исследованиям, произведенным за последние 40 лет, когда были применены новые методы физической химии, были разъяснены многие вопросы, касающиеся состава и химического строения сплавов. Не считая возможным перечислять имена многочисленных ученых, занимавшихся изучением сплавов, не можем не указать, что исследования академика профессора Н. С. Курнакова и Густ. Таммана (сперва профессора Юрьевского, а затем Геттингенского университета) и их многочисленных сотрудников пролили много света в эту темную область.
Сплавы являются застывшими растворами (см. растворы), поэтому прогресс, который произошел в области изучения растворов, благодаря трудам Вант Гоффа и др., вызвал успех в области изучения сплавов, так как те законности, которые были установлены для водных растворов, могли быть применены соответственным образом также для сплавов. «Сплавы столь сходны с растворами», говорит Д. И. Менделеев, «что к ним можно относить то, что известно для растворов и обратно. Но в сплавах, как в веществах, легко переходящих из жидкого состояния в твердое, легче открыть образование определенных химических соединений».
Сплавы получаются при расплавлении двух или нескольких металлов, причем последние взаимно растворяют друг друга. В технике обычно этим способом и пользуются. Но сплавы могут образовываться при прямом тесном соприкосновении различных металлов друг с другом. Бельгийский ученый Спринг показал, что измельченные в порошок металлы под давлением нескольких тысяч атмосфер превращаются в сплошные куски металла, так, например, свинец дает сплошные куски, похожие на литой металл при давлении до 2000 атмосфер. Для олова требуется давление в 3100, для меди и висмута — 5000, а для алюминия, цинка и сурьмы — в 6000 атм. Сжимая смесь порошков из 15 частей висмута, 8 свинца и 3 кадмия, Спринг получил однородный сплав, плавящийся при 100°. Для получения вполне однородного сплава нужно сжимать смесь два или три раза: во второй и третий раз нужно подвергать сжатию продукт предыдущего сжатия, превращенный в порошок. При приготовлении цементной стали железные полосы, пересыпанные порошком угля, накаливают без доступа воздуха; при этом железо, не плавясь, поглощает частицы угля, которые с поверхностных слоев переходят постепенно в более глубокие слои, и получается сплав железа с углем—сталь.
Подобно тому, как частицы твердого тела, положенного в воду, диффундируют (см. XVIII, 434) в последнюю, так и металлы могут диффундировать друг в друга, причем наблюдается образование сплава. Спринг произвел следующий опыт: на небольшой цилиндр из красной меди с хорошо отшлифованной поверхностью он наложил подобный же цилиндр из цинка и поместил в шкаф, температура коего была от 300° до 350°, т. е. ниже температуры плавления наиболее легкоплавкого металла — цинка. Через несколько дней можно было заметить на соприкасающихся поверхностях, как меди, так и цинка тонкий слой латуни (сплавы меди, и цинка), т. е. атомы меди проникли в цинк, и обратно, атомы цинка в медь.
Когда два расплавленных металла приходят в соприкосновение друг с другом, то при этом наблюдается то же явление, что при смешении двух жидкостей: металлы могут растворяться друг в друге или во всевозможных количественных отношениях, подобно серной кислоте и воде и т. п., или же только отчасти растворяются друг в друге (подобно эфиру и воде, хлороформу и воде), и тогда образуются два слоя: в верхнем избыток более легкого металла, в нижнем — более тяжелого. Пример: если сплавить в равных частях цинк и свинец и оставить в покое расплавленную массу, то она разделится на два слоя: верхний — представляет раствор свинца в цинке, а нижний — раствор цинка в свинце. При застывании верхнего слоя получается сплав с 0,2% свинца, а из нижнего — сплав, содержащий 0,6% цинка. То же наблюдается для олова и цинка, для таллия и свинца и др. Это явление разделения расплавленных сплавов при медленном застывании на два сплава, различных по составу, твердости и плавкости носит название ликвации или зейгерования.
При внесении одного металла в расплавленный другой может происходить выделение тепла и иногда очень значительное. Примеры: 1) натрий, калий, погруженные в ртуть, растворяются в ней, выделяя большое количество тепла и даже света. 2) При погружении алюминия в расплавленную при белокалильном жаре медь происходит такое выделение тепла, что вся масса доходит до ярко-белого каления. 3) Металлическая платина, приведенная в соприкосновение с расплавленной сурьмой, растворяется в ней с таким громадным выделением тепла, что вся масса накаливается до ярко-красного каления. Выделение тепла указывает на то, что сплавление металлов сопровождается образованием прочного химического соединения. Последнее подтверждается другими, методами исследования, которые показывают, что натрий (и калий) образует ряд соединений состава NaHg, NaHg2, KHg2, алюминий и медь образуют алюминиевую бронзу состава AlCu3, а соединение платины и сурьмы обладает формулой PtSb2. По своим свойствам такие соединения металлов резко отличаются от своих компонентов или составных частей (см. ниже). Образовавшиеся соединения затем растворяются в избытке того или другого компонента, и образуется раствор, который при охлаждении ведет себя подобно водным растворам: если мы имеем нагретый раствор какой-либо соли в воде, то, смотря по концентрации соли в растворе, выделяется или соль, или же, в случае очень разведенного раствора, лед при температуре ниже 0° (см. металлография, XXVIII, прил. 28).
Аналогичное явление наблюдается при застывании растворов. Доказательством того, что сплавы и растворы повинуются одним законам, может служить, между прочим, применение способа депрессии (понижения) температуры застывания к растворам различных металлов в олове. Гейкокк и Новилль показали, что от подмеси малого количества различных металлов в олово температура застывания расплавленного олова понижается пропорционально концентрации раствора, совершенно так же, как это наблюдается для температуры образования льда в водных растворах (закон Рауля). Причем для растворов, содержащих одно и то же число молекул или атомов (эквимолекулярных или эквиатомных), понижение температуры застывания одинаково.
Растворяя в 11900 частях олова грамматомы металлов (т. е. 65 г Zn, 63,5 г Сu, 108 г Аg и т. д.), наблюдали следующие понижения температуры затвердевания олова: при Zn 2°,53, Сu 2°,47 Аg 2°,67, Сd 2°,16. Рb 2°,22, Hg 2°,3, Sb 2°,0, Аl 1°,334. То же наблюдается для растворов Мg, Nа, Nі, Аu, Pd, Ві и Zn.
При образовании сплавов Сu и Zn, Сu и Sn и т. п. происходит сжатие (и выделение тепла). При сплавлении же Ag и Сu, Ag и Рb замечается некоторое увеличение объема.
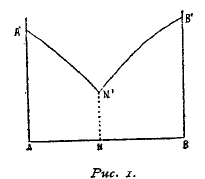
Рис. 1.
Систематическое изучение кривых застывания, как водных растворов, так и сплавов, разъяснило много вопросов, касающихся строения сплавов. При этом пользуются графическим методом. По горизонтальной линии АВ (рис. 1) откладывают процентный состав сплавов, образуемых металлами А и В, причем крайняя точка принадлежит чистым металлам (100% А и 100% В). Процентный состав может быть отнесен или к 100 весовым частям или к 100% грамматомам металлов, образующих систему (атомные проценты). Последний способ выражения концентрации более прост и удобен. По вертикальному направлению откладывают температуры плавления чистых металлов А и В. От прибавления В к А температура плавления сплава понижается тем более, чем более прибавлено тела В, хотя бы оно плавилось выше, чем А. При этом в твердом виде выделяется только А. Равным образом при прибавлении А к В температура застывания сплава будет ниже точки В, и понижение будет тем значительнее, чем больше тела А находится в сплаве. При этом будет застывать только тело В, а расплавленный сплав все более будет обогащаться телом А и поэтому застывать при все более и более пониженной температуре.
Кривые А'N' и В'N' показывают изменение понижения температуры застывания сплава в зависимости от концентрации, причем по линии А'N' из раствора выделяется тело А, а по линии В'N' тело В, точка же N показывает такой состав сплава, при котором сплав застывает нацело, т. е. из него одновременно выделяются А и В в том же количественном отношении, в каком они находятся в жидком сплаве. Такой раствор называется эвтектической смесью, а температура, соответствующая точке N' эвтектической (см. XXVIII, 528); она является наинизшей температурой застывания сплавов А и В. Если мы имеем раствор двух тел А и В, то при его охлаждении будет сперва выделяться тело А или В, смотря по тому, какой металл будет находиться в избытке сравнительно с тем раствором, состав коего указан точкой N. Такое выделение будет происходить до тех пор, пока состав маточного раствора достигнет точки N, и тогда сплав застынет нацело. Приведем следующий пример. Температура плавления свинца 326°, а сурьмы 630°, эвтектическая точка N' лежит при 22 °, эвтектическая же смесь состоит из 13% Sb и 8% Рb. Если расплавленный сплав содержит менее 13% Sb, то он начинает застывать выше 228°, и при этом выделяется чистый свинец. Процентное содержание сурьмы в расплавленной массе повышается, и температура застывания понижается. Когда же содержание сурьмы повысится до 13%, сплав нацело застынет при 228°. При содержании в жидком сплаве более 13% сурьмы, будет происходить сперва выделение сурьмы до тех пор, пока содержание ее не понизится до 13%, тогда произойдет окончательное застывание сплава при 228°.
В том случае, когда металлы А и В не просто растворяются друг в друге, а образуют одно или несколько определенных соединений друг с другом, кривая плавкости принимает более сложный вид (рис. 2).
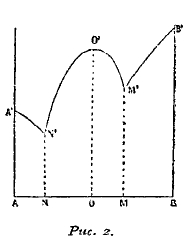
Рис. 2.
В простейшем случае, когда металлы образуют одно соединение, получается кривая A'N'О'M'В, в коей точка О' соответствует температуре плавления соединения, АВ, а точки N' и М' — эвтектические точки, причем при N' из раствора выделяется эвтектическая смесь тела A и его соединения с телом В, а при М' эвтектическая смесь из тела В и его соединения с телом А.
По линии A'N' из раствора при застывании выделяется тело А, по линиям О'N' и О'М' —определенное соединение тел А и В, а по линии В'М' — тело В. В том случае, когда тела А и В образуют несколько определенных соединений, кривая принимает более сложный вид (см. рис. 3, кривую А' N' О' М Р' R Q' S В'). Точки О', Р', Q' соответствуют температурам плавления определенных соединений, состав коих указывают точки О, P и Q. Точки N, М, R, S представляют эвтектические точки. При этом нужно отметить, что температура плавления сплавы лежит выше таковой наиболее тугоплавкого металла, входящего в соединение, например сплавы золота с алюминием, АuАl2, отличающийся характерным пурпурным цветом, плавится на 32,5° выше точки плавления золота, амальгама натрия, NaHg2 плавится при 346°C, тогда как Nа плавится при 90° и т. д. Если определенные соединения между А и В не отличаются стойкостью и плавятся, разлагаясь, то диаграммы плавкости представляют более сложную картину, но, как бы то ни было, изучение подобного рода кривых привело к определению целого ряда химических соединений, образуемых металлами друг с другом (см. ниже).
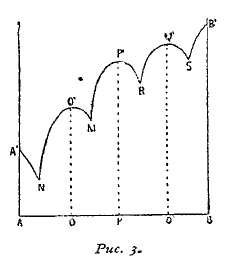
Рис. 3.
В рассмотренных случаях было принято, что состав твердого двойного соединения сохраняется постоянным при изменениях концентрации жидкого раствора. Но в области сплава могут происходить осложнения вследствие образования так называемых твердых растворов. Этим именем Вант-Гофф предложил обозначать твердую однородную смесь двух или нескольких тел, отношение между количествами которых может меняться без изменения однородности. К ним относятся стекла, изоморфные смеси и т. п. Подобно тому, как существуют жидкости, смешивающиеся между собой во всевозможных отношениях, так и некоторые изоморфные тела могут быть в кристаллах при всевозможных отношениях между составными частями.
При кристаллизации из водных растворов смеси двух изоморфных тел выделяется кристаллы, содержащие оба тела в различных отношениях. Так, при кристаллизации смесей изоморфных хлорноватых солей калия и таллия KClO3 и TlClO3 при различном содержании обеих солей в растворе выделяются кристаллы или с избытком первой соли от 96% до 100% или с избытком второй соли от 64% до 100%. Равным образом, некоторые сплавы тоже представляют твердые растворы, т. е. при их застывании металлы не выделяются в отдельности (как было указано выше), а остаются равномерно распределенными по всей массе сплава.
Некоторые металлы могут образовать твердые растворы, причем оба компонента смешиваются во всевозможных отношениях, другие металлы образуют твердые растворы с ограниченной растворимостью: так, по Н. С. Курнакову, в случае таллия и свинца получаются: 1) α—твердые растворы (О—6 5% Рb), выделяющиеся в форме модификации свинца, устойчивой выше 227° и 2) β—растворы (24,7% - 100% ат.), кристаллизующиеся подобно свинцу в октаэдрах правильной системы. Диаграмма плавкости сплавов, образующих твердые растворы, будет отличаться от изображенных на рис. 1—3.
Часто она представляет почти прямую линию, которая соединяет точки плавления обоих компонентов, т. е. температура застывания таких сплавов лежит между температурами плавления составляющих. Но наблюдаются также случаи, когда кривая застывания лежит выше, иногда же ниже прямой линии, соединяющей точки плавления чистых компонентов (рис. 4).
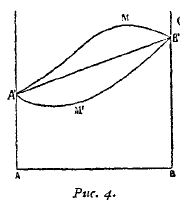
Рис. 4.
Для изображения диаграммы плавкости сплавы, состоящих из трех металлов, можно воспользоваться прямой призмою (рис. 5). А', В' и С' обозначают точки плавления чистых компонентов. Если мы к компоненту А будем прибавлять компонент В, растворимый в жидком А, то точка замерзания А понижается; то же самое происходит с точкой замерзания В от прибавления А. Поэтому мы получаем кривую замерзания А'k2В' для системы из двух компонентов А и В; k’ эвтектическая точка. Эта кривая лежит на одной из боковых поверхностей призмы. Совершенно так же мы получаем кривые замерзания А'k2С'1 и В''k3С'.
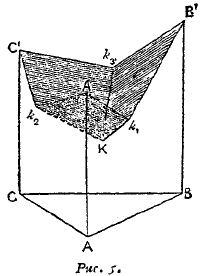
Рис. 5.
Эти кривые изображают состав двойных жидких сплавов, которые находятся в равновесии с одним из чистых компонентов, а при эвтектической точке, со смесью из двух твердых компонентов.
Если теперь к системе, которой соответствует точка k1, прибавить небольшое количество третьего компонента сплава, то температура, при которой обе твердые фазы могли сохранять равновесие с жидким сплавом, понижается, и это понижение эвтектической точки тем сильнее, чем больше прибавлено компонента сплава. Таким образом, мы получаем кривую k1K, изображающую состав тройной жидкой фазы, с которой смесь из твердых А и В находится в равновесии. Кривые k2К и k3K представляют соответствующие эвтектические кривые для твердых фаз А и С и для твердых фаз B и С, находящихся в равновесии с тройными растворами.
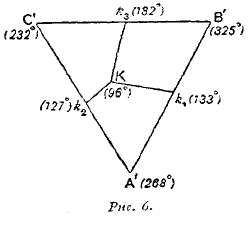
Рис. 6.
При точке K находится три твердых компонента в равновесии с жидким сплавом, и поэтому точка K представляет самую низкую температуру плавления для жидкой смеси, находящейся в равновесии с тремя твердыми компонентами. Всякая из тройных эвтектических кривых, как их можно назвать, происходит от пересечения двух в тройной эвтектической точке пересекается три поверхности, именно: А'k1Kk2, В'k1Kk3 и С'k3Kk3.
Вместо того, чтобы употреблять призму, можно изменение состава тройных растворов изобразить при помощи проекций кривых k1K, k2K и k3K на основании призмы. Относящаяся сюда температура отмечается тогда, как на рис. 6 подле различных эвтектических точек и кривых.
Числа этой диаграммы принадлежат эвтектическим точкам системы: висмут, свинец, олово. Данные для этой системы следующие:
|
Точки плавления чистых металлов |
Состав двойных эвтектических смесей |
Температура двойных эвтектических точек |
|
|
Bi 268° |
Bi Pb Sn |
Bi-Pb 127° |
|
|
Pb 325° |
55 45 42 |
Bi-Sn 133° |
|
|
Sn 232° |
58 37 63 |
Pb-Sn 182° |
|
|
Состав тройной эвтектической смеси |
Температура эвтектической точки |
||
|
Bi Pb Sn 51 32 16 |
96° |
||
В рассмотренном случае компоненты выкристаллизовываются из раствора в чистом состоянии. Когда же раствор может выделить твердое соединение двух компонентов, то фигура принимает иной вид. Кривые, которые получаются в таком случае, представлены на рис. 7.
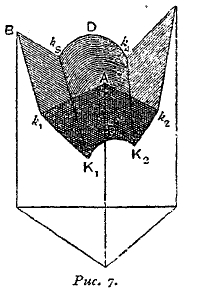
Рис. 7.
Из фигуры видно, что оба компонента В и С образуют соединение, и кривая замерзания на фиг. 7 обладает максимумом. Существуют две тройных эвтектических точки К1 и К2. В точке К1 выделяются в твердой фазе А, В и соединение, а в точке К3, А, С и соединение.
Благодаря многочисленным исследованиям кривых плавкости (так называемого термического анализа), в настоящее время (1926 г.) можно считать установленным состав и строение многих сплавов.
Из известных определенных соединений металлов укажем следующие:
Рис
Профессор А. А. Байков предложил следующую попытку классификации системы металлических соединений.
Тип бронзы RМ3, где R — металл V группы периодической системы (см. XXXI, 586), он может быть заменен металлом IV группы, М — металл I группы. Сюда принадлежат бронзы: сурьмяная SbCu3, серебряная SbAg3 (аналоги сурьмянистого водорода), оловянная SnCu, соединение висмута BiNa3 (BiCu3).
Тип латуни R2M, где R — металл I группы, R — металл II группы, он может быть заменен металлом IIІ группы. К этой группе относятся — латуни: цинковая Zn2Cu, кадмиевая Cd2Cu и соединение Cd2Na; амальгамы: Hg2Na, Hg2K, Hg2Tl и соединения алюминия с медью Al2Cu и золотом АІ2Аu. Тип RR1, сюда относятся AlSb, SnSb и, наконец, тип MM1 : KTl (KNa), NaTl.
Кроме того, при сопоставлении соединений одноатомного металла с металлами других групп наблюдается правильное возрастание числа атомов первого металла по мере увеличения кислотных свойств второго металла. Так, для натрия получается следующий хорошо изученный ряд: NaTl, Na2Pb, Na3Bi.
Сплавы редко представляют чистые определенные соединения, в большинстве же случаев сплавы представляют сложную систему, в состав коей входят: определенные соединения различного состава, твердые растворы и эвтектическая смесь как соединения, так и отдельных металлов, его составляющих.
Физические свойства сплавов. При образовании сплавов происходит сжатие, а в некоторых случаях расширение.
При образовании сплавов Cu+Zn, Cu+Sn, Cu+Bi, Cu+Sb, Pb+Sb, Ag+Sn, Au+Zn происходит сжатие (и выделение тепла). При сплавлении же Fe+Sb, Fe+Pb, Cu+Pb, Pb+Sn, Pb+Sb, Zn+Sb, Ag+Cu, Au+Cu замечается некоторое увеличение объема.
Примером особенно сильного сжатия может служить сплав меди с оловом (38%). Удельный вес сплава равен 8,91, между тем как удельный вес меди 8,89, олова 7,31, откуда можно вычислить, что объем сплава составляет только 92,2 суммы объемов меди и олова.
На свойства сплавов сильно влияет их термическая обработка, т. е. медленно или быстро они будут охлаждаться. Не останавливаясь на известном явлении закалки и отпускания стали, укажем, что аналогичные явления замечаются и для других сплавов. Так, Шарли показал, что механические свойства и микроструктура сплава меди и цинка сильно изменяются под влиянием продолжительного нагревания. При остывании сплава олова и меди между 500° и 600° происходит замедление скорости охлаждения от того, что происходит какое-то превращение сплава, сопровождающееся выделением тепла. А. А. Байков нашел, что из двух соединений сурьмы с медью, SbCu3 и SbCu2, первое, имеющее зеленовато-белый цвет и плавящееся без разложения при 680°C, существует в двух видоизменениях, точка перехода между которыми лежит при 410°. С медью и сурьмой SbCu3 дает твердые растворы, образование и распадение коих является причиной закалки этих сплавов совершенно аналогичной явлениям закалки стали. Удельный вес двух разновидностей SbCu3 различный: 8,51 для быстро охлажденной и 8,68 для медленно охлажденной. Переход одной разновидности в другую сопровождается выделением тепла. В связи с этим наблюдается различие в строении и свойствах между закаленными и отпущенными сплавами сурьмы и меди. Различие это происходит от того, что разновидность стойкая выше 400°С образует твердые растворы с Сu и Sb, которые при охлаждении распадаются с выделением этих металлов, так как вторая разновидность не способна образовать твердых растворов.
При быстром же охлаждении не происходит перехода первой разновидности во вторую, и твердые растворы не распадаются. Изучение явления закалки сплавов представляет большой интерес, ибо эти исследования могут послужить для разъяснения вопроса о закалке стали и т. п.
К сведениям о плавкости сплавов добавим данные о температуре плавления некоторых легкоплавких сплавов:
Сплав натрия и калия NaK плавится при 8°С
Металл Розе I Bi2PbSn – 93,75
Металл Розе II Bi4Pb4Sn6 – 90
Сталь Вуда I Bi4Cd2PbSn2 – 80
Сталь Вуда II Bi8Cd3Pb4Sn4 – 67,5
Сталь Вуда III Bi10Cd4Pb5Sn5 – 65,5
Сталь Липовитца I Bi21Cd4Pb6Sn5 - 70
Цвет сплава часто сильно отличается от такового металлов, его составляющих: так, латунь желтого цвета, если она содержит 80% Сu, и белого — при 30% Сu. Золото краснеет от прибавки Сu и принимает зеленоватый оттенок при сплавлении с серебром, с алюминием же делается пурпурно-красным.
Изучение электропроводности, а также твердости и текучести металлов, произведенное в последнее время Н. С. Курнаковым и его сотрудниками пролило много света на вопрос о строении сплавов. Вкратце сообщим следующие данные.
I. В случае сплавов, образованных простым соположением кристаллов двух металлов, электропроводность должна быть равна сумме электропроводностей соответственных количеств двух металлов, входящих в состав сплавов. К этой группе принадлежат сплавы металлов Pb, Sn, Cd и Zn.
Удельная электропроводность (k) сплавов этих металлов может быть определена по формуле:
k = (k1r1 + k2r2 + k3r3 +…)/(v1 + v2 + v3)
где k1, k2 обозначают удельные электропроводности отдельных металлов, v1, v2 — объемы, в которых эти металлы входят в состав сплавов.
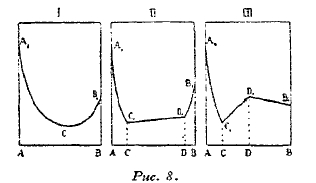
Рис. 8.
Температурный коэффициент сопротивления этих сплавов весьма близок к температурному коэффициенту чистых металлов. Температурный коэффициент вычисляется по той же формуле и поэтому он отличается немного от 0,004.
II. В случае образования твердых металлических растворов происходит понижение электропроводности.
III. Кривые электропроводности сплавов, образующих непрерывный ряд смешанных кристаллов, идут также непрерывно от одного компонента до другого, имеют, однако, глубокий минимум и достигают электропроводности чистых компонентов, весьма круто поднимаясь, так что в области малых концентраций какого-либо компонента в смешанных кристаллах дальнейшее его прибавление вызывает несравненно большее понижение, нежели при более сильных концентрациях, и обратно.
В случае ограниченной способности смешения компонентов в кристаллическом состоянии в области насыщенных смешанных кристаллов применима І-ая законность как для чистых компонентов, для чистого же металла и насыщенных смешанных кристаллов применимо положение ІІ-ое.
На основании этих законностей Н. С. Курнаковым и С. Ф. Жемчужным изображены три типические диаграммы простейших случаев двойных систем, в состав коих входят металлы, способные давать твердые растворы. По оси абсцисс отложены концентрации сплавов, а по оси ординат — электропроводность.
Диаграмма 1 (рис. 8) отвечает случаям, когда компоненты А и В образуют непрерывную изоморфную смесь.
В том случае, когда металлы могут растворяться не во всех отношениях, а только отчасти, т. е. при наличности разрыва CD в концентрации твердых растворов, диаграмма электропроводности составлена из трех ветвей A'C', C'D' и D'В (рис. 8-11). Две нисходящие боковые кривые А'С' и В'D' определяют понижение электропроводности обоих металлов A и В в зависимости от концентрации АС и ВС образующихся твердых растворов. Средний участок С'D' представляется в виде прямой линии, изображающей изменения электропроводности механической смеси двух твердых растворов предельных концентраций AС и BD, из которых состоит затвердевший сплав в области разрыва CD.
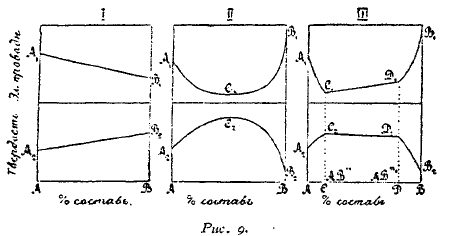
Рис. 9.
Что касается до электропроводности амальгам, то при прибавлении к ртути небольшого количества какого-либо металла, электропроводность ее увеличивается и для металлов олова и кадмия приближается к электропроводности этих металлов, а для висмута или свинца электропроводность сперва растет, достигает максимума, затем минимума, после которого опять увеличивается. Такого рода ход кривой указывает на образование химического соединения между ртутью и металлом.
Температурный коэффициент сплавов, образующих твердые растворы, значительно меньше, чем чистых металлов. Следующие сплавы отличаются весьма малой величиной температурного коэффициента:
Нейзильбер (60% Сu, 21% Ni, 19% Zn), а = 0,00037.
Никкелин (54% Сu, 26% Ni, 20% Zn), а = 0,0002.
Манганин (84% Сu, 4% Ni, 12% Мn), а = 0,00002.
Константан (58% Сu, 41% Ni, 1% Мn), a = 0,00003.
Платиноид (Ni, Zn, Сu и W), а = около 0,00003.
Твердость сплавов в большинстве случаев более таковой металлов, входящих в состав сплава. Так, чистая медь тверже чистого олова, а твердость сплава, содержащего 5% Sn и 95% Сu, почти вдвое больше твердости чистой меди. Твердость золота и серебра значительно повышается от прибавления к ним меди. Изнашивание серебряно-медных сплавов, содержащих 10% меди, составляет 8/15 изнашивания чистого серебра.
Исследования Н. С. Курнакова и др. показали:
1.Твердость особенно повышается для сплавов, образующих твердые растворы.
2. Изменения твердости непрерывного ряда твердых растворов выражаются непрерывной кривой, обладающей максимумом (рис. 9, II).
3. Если сплавы представляет механическую смесь металлов, то твердость сплава является средней из таковых чистых металлов, и зависимость ее от состава изображается прямой линией (см. рис. 9, I).
4. Если металлы обладают ограниченной способностью образовать твердые растворы, то изменения твердости сплава могут быть представлены кривой III на рис 9, на которой восстающие ветви А2С2 и D2B2 указывают на непрерывное увеличение твердости до предельных концентраций твердых растворов АС и DB. Прямолинейный участок С2D2 принадлежит сплаву, в области разрыва сплошности представляющим механическую смесь предельных твердых растворов АС и DB.
5. Для непрерывных твердых растворов (изоморфных смесей) максимум диаграммы твердости соответствует минимуму электропроводности, как это можно видеть на диаграммах рис. 9.
6. В том случае, когда металлы образуют определенное химическое соединение, твердость последнего по отношению к компонентам двойной системы может быть весьма разнообразна. Иногда соединение является мягче своих составляющих. На диаграмме рис. 10 такие отношения изображены пересечением пунктирных прямых А2М2 и М2В2, в точке М2, лежащей ниже А2. Но во многих случаях, когда образование определенного соединения сопровождается выделением тепла, происходит возрастание твердости, и определенному соединению принадлежит максимум твердости М2, находящийся в точке пересечения прямых линий А2М2 и В2М2. Для иллюстрации приведем несколько примеров: твердость магния по шкале Моса равна 2, олова 1,8, а Mg2Sn 3,5, для Сu 3,0, для MgCu2 4,5 и для Cu3Sn 4,5 и т. д.
В близком соотношении с твердостью тел находится их текучесть, т. е. способность вытекать при действии сильного давления из узкого отверстия в виде сплошной струи.
Первые количественные определения в этом направлении были сделаны Треска в 1868 г. Он помещал лед, глину, свинец, олово, алюминий, медь и др. тела слоями под поршень в цилиндрический сосуд, на дне коего было сделано круглое отверстие. При достаточно большом давлении, доходившем до 100 000 кг, названные тела начинали выходить из отверстия в виде непрерывной струи. С момента появления последней устанавливалось некоторое давление, сохранявшееся постоянным при дальнейшем вытекании. Впоследствии Дьюар, Гейдвейллер, Тамман и др. занимались этим вопросом. Точными измерениями скорости истечения пластических тел мы обязаны Г. Такману и его ученикам. Исследованные ими металлы можно расположить в следующий ряд по мере уменьшения скоростей истечения или пластичности слева направо: K, Na, Pb, Tl, Sn, Bi, Cd, Zn, Sb.
Систематические исследования Н. С. Курнакова и его сотрудников над давлением истечения сплавов привели его к следующим выводам:
1. Давление истечения, измеренное при определенных условиях, представляет одну из важных величин для характеристики пластического вещества. Оно является очень чувствительным реагентом на изменение состояния тела.
2. Между давлениями истечения и данными твердости наблюдается полный параллелизм, так что по твердости можно определять давления истечений и наоборот.
3. Диаграмма давлений истечения или твердости сплава является как бы обращенной диаграммой электропроводности. Максимумы первой отвечают минимумам второй. Таким образом, изучение кривых электропроводности, твердости и т. п. наряду с кривыми плавкости может указывать на изменение внутреннего строения сплавов.
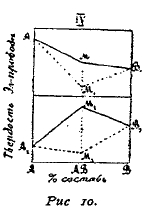
Рис. 10.
Что касается до ковкости и вязкости сплавов, то они значительно меньше, чем чистых металлов. Золото и серебро при сплавлении с медью заметно теряют в ковкости и вязкости. Особенно опасным врагом для ковкости многих металлов — Au, Ag, Pb, Sn, Cu и многих других — является висмут. Достаточно 0,05% висмута для каждого из этих металлов, чтобы сделать их совершенно негодными к обработке, требующей высокой степени ковкости.
Литература по сплавам очень обширна, как русская, так и иностранная. Статьи, посвященные сплавам, помещены в различных периодических изданиях: «The Mctallographist» «Engineering», «Bulletin de la société d'Encouragementp. l'Industrie nationale», «Zeitschrift f. Elektrochemie», «Zeitschr. f. Anorganische Chemie», «Zeitschr. f. Physikalische Chemie» и мн. др.
Для изучения сплавов в Англии создан особый Комитет «Alloys Research Commitee», а в 1896 г. во Франции — Комиссия сплавов «Comission des Alluages». В 1900 г. по инициативе профессора Н. С. Курнакова основана Русская Металлографическая Комиссия для исследования сплавов при Русском Техническом Обществе. Из русских отдельных изданий укажем:
А. П. Курдюмов, Монография о медно-цинковых сплавах. Материалы для изучения и собственных исследованиях с 2 атласами. Пет., 1904. В первых 6-ти главах находится обстоятельное изложение учения о сплавах, изоморфных группах, неорганических и органических соединениях, учения о фазах кривых плоскости, а также описаны различные методы изучения сплавов; А. А. Байков. Исследование сплавов меди и сурьмы и явлений закалки в них наблюдаемых. СПБ, 1902; Материалы для изучения металлографии, изданные под ред. профессора Н. С. Курнакова. СПБ. I, II, III, 1902-1906. В них находятся статьи Ле Шателье, Г. Готье и Шарпи, Роберта Остена и др. о различных свойствах сплавов и методах их исследования. Многочисленные труды Н. С. Курнакова и его сотрудников, посвященных сплавам, помещены в «Журнале русского Физико-Химического Общества», в «Известиях Петербургского Политехнического Общества», «Известиях Российской Академии Наук» и др.; Н. М. Витторф, Теория сплавов в применении к металлическим системам. СПБ, 1909.
И. Каблуков.
| Номер тома | 41 (часть 4) |
| Номер (-а) страницы | 170 |
