Таутомерия
Таутомерия (динамическая изомерия, десмотропия), особый вид структурной изомерии (см. стереохимия), проявляющийся в том, что определенное соединение иногда реагирует как имеющее одно, а иногда как другое строение. Так, ацето-уксусный эфир реагирует иногда как СН3СОН = СНСООС2Н5 (энольная форма), иногда как
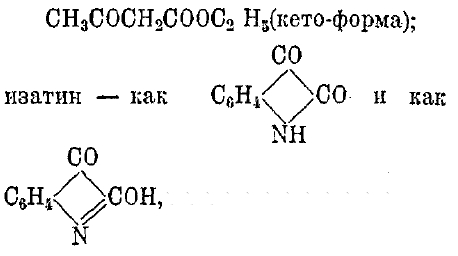
причем известны производные от той и другой формулы. Подобный вид таутомерии очень распространен и носит название кето-энольной таутомерии. Ее обнаруживают фенолы (резорцин, флороглюцин), мочевина и мочевая кислота и др. Случаи таутомерии наблюдаются и среди более простых соединений: HCN, HSCN, HNО2. Каждой из этих формул отвечает по одному известному соединению, но при замещении водорода на радикалы (R) от каждого получается по два ряда производных
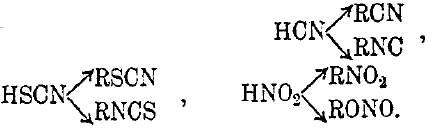
Имеется и много других групп таутомерии. Например, одна из форм неспособна давать солей с металлами, но способна переходить в другую, дающую соли — первая форма называется псевдокислотой (нитросоединения). Известны и псевдооснования, дающие соли с кислотами, только отвечающие таутомерной форме — это псевдооснования. Подобные отношения часто наблюдаются в группе красок. Далее интересная таутомерия наблюдается среди глюкоз: альдегидные, кетонные и окисные формы глюкоз способны переходить друг в друга, и им отвечают самостоятельные производные.
В разработке вопроса о таутомерии принимал участие ряд выдающихся ученых: Бутлеров, Байер, Вислиценус, Кнорр, Лaap, К. Мейер и др. В результате, относящиеся сюда явления классифицированы, выработаны особые методы исследования, и разъяснены, отчасти, причины таутомерии. Главнейшее сводится к следующему. В кристаллическом состоянии вещество однородно и представляет одну из форм, которую и удается иногда выделить. Но в парах, растворах и даже, обычно, в расплавленном состоянии находятся обе формы в состояния динамического равновесия, т. к. они могут переходить одна в другую. Состояние равновесия подчиняется общим законам химической статики и динамики. Оно зависит от природы вещества, растворителя и температуры. Согласно правилу Ле-Шателье—Вант-Гоффа, с повышением температуры равновесие смещается в сторону (образования формы), требующую поглощения тепла. Исходя из того или другого таутомера, мы приходим к одному и тому же состоянию равновесия при одинаковых условиях, но с различной скоростью. Скорости превращения формы А в В и В в А различны. Эти скорости сильно зависят от температуры, растворителя и присутствия катализаторов. Отношением этих скоростей определяется состав равновесной смеси. Если скорости очень различны, то равновесная система состоит почти из одной формы: это случай настоящей таутомерии; в случае присутствия в смеси двух форм — имеется десмотропия. В жидком ацетоуксусном эфире находится 7,4% энольной формы и 92,6% кетонной. Для исследования состава равновесных десмотропных систем применяются как физические методы (особенно определение показателя преломления), так и химические (титрование бромом, окраска с FеСl3 расщепление озоном и др.). На явления таутомерии существовали разные взгляды. А. М. Бутлеров первый высказал мысль, что она объясняется тем, что здесь имеются структурные изомеры, могущие превращаться один в другой (современное воззрение). Лаар полагал, что частицы одного и того же вещества вследствие колебаний атома водорода имеют в разные моменты различное строение. От изучения явлений таутомерии следует ожидать еще многих важных результатов.
Н. Демьянов.
| Номер тома | 41 (часть 7) |
| Номер (-а) страницы | 100 |
