Топливо
Топливо. Горением в широком значении слова называют всякий химический процесс, который совершается с развитием света и теплоты. Поэтому всякое вещество, которое способно вызывать такой процесс, можно было бы назвать топливом. Но, ограничиваясь практическими потребностями, названием топливо обозначают только такие тела, теплота которых, выделяемая при горении, используется в домашнем хозяйстве и в промышленности для производства работы и для нагревания. В этом, более узком значении слова понятие топливо охватывает уже много меньший круг веществ.
Прямо или косвенно все виды топлива являются продуктами органической жизни в природе. Все, что произведено этой жизнью, будет ли оно растительного или животного происхождения, способно гореть. Одни виды топлива применяются такими, какими их дает природа; это — естественное топливо. Другие виды топлива получаются путем механической или химической обработки естественного топлива; такое топливо называют искусственным, иногда также облагороженным. К естественному топливу относятся: дерево, торф, бурый уголь, каменный уголь, горючие сланцы, сера, нефть, натуральный газ. К искусственному топливу принадлежат: древесный уголь, полукокс, газовый кокс, металлургический кокс, брикеты (торфяной, буроугольный, каменноугольный), промышленные смолы (торфяная, буроугольная, каменноугольная, сланцевая), пек, производные нефти (бензин, керосин, мазут), производные промышленных смол (бензол и др.), спирт, светильный газ, колошниковый газ, коксовальный газ, воздушный газ, смешанный газ, водяной газ. По своему агрегатному состоянию топливо делится на твердое, жидкое и газообразное.
Из всех видов современного топлива самым важным является ископаемый уголь. Теперь уже нет разногласий в вопросе о происхождении углей. Прежние теории о минеральном происхождении их ныне окончательно оставлены. В настоящее время причину образования углей видят в накоплении громадных растительных масс в отдаленные периоды существования земли. По внешнему виду различают два главных типа углей — блестящий и матовый. В так называемом полосатом угле блестящий и матовый уголь находятся непосредственно один возле другого. Кроме того, на поверхности пласта блестящего угля находится еще волокнистый уголь, образование подобное древесному углю и богатое золой. В противоположность блестящему и матовому, этот уголь сильно пачкается. О происхождении его еще нет ясного представления (см. каменный уголь, ХХIII, 235/36, прил. 1/22). Исследования последних лет обнаружили, что блестящий уголь в свою очередь состоит из двух различных составных частей. Таким образом, различают четыре типичных разновидности угля, которым даны следующие названия; фюзэн, дюрэн, кларэн и витрэн. Фюзэн (fusain) — материнский, или минеральный, древесный уголь. Он рыхл и мягок, встречается в виде пластинок и в клинообразной форме; состоит из порошкообразных, иногда волокнистых прядей. От остального угля фюзэн легко отделяется посредством скобления тупым ножом, причем на подложенную бумагу падают короткие волокнистые пряди и небольшие иглообразные обломки. Дюрэн (durain) — матовый уголь, тверд и плотен, имеет прочное строение и представляется даже невооруженному глазу довольно зернистым. Матовая поверхность его излома в действительности никогда не бывает гладкой, но имеет комковатый вид. Обыкновенно в самых тусклых полосах дюрэна можно заметить также клочки или тонкие, как волос, нити блестящего угля. Кларэн (clarain) — блестящий уголь с гладким изломом. Витрэн (vitrain) — блестящий уголь c раковистым изломом и сильным блеском. Эти четыре разновидности угля различаются по своему химическому строению, поведению при коксовании и по характеру их золы. Микроскопическое исследование неразведанных тонких шлифов угля дает для фюзена то хорошо заметную, то нежную структуру дерева с черными и непрозрачными клеточными стенками. Дюрен обнаруживает зернистое строение из круглых и многоугольных, большей частью просвечивающих обломков, среди которых встречаются в большом числе споры, окрашенные в цвета от золотистого до оранжевого. Кларэн оказывается самым удобным для изготовления шлифа. Здесь наблюдаются небольшие ветки, споры и более или менее хорошо просвечивающие различного рода образования. Витрэн представляет почти бесструктурное образование различной окраски, в зависимости от толщины разреза, которая никогда не бывает совершенно равномерной. Часть угля, нерастворимую в пиридине, называют α, растворимую в пиридине, но нерастворимую в хлороформе, обозначают буквой β, а ту часть, которая после растворения в пиридине воспринимается также хлороформом, называют γ-часть. При коксовании витрэн дает пористый, сильно вспученный кокс, имеющий форму гриба. Этот кокс хорошо сплавлен, но непрочен, имеет серебряно-белый цвет. Кларэн при коксовании дает значительно оплавленный буроватый кокс. Фюзэн еще при 900° сохраняет свой наружный вид и дает порошкообразный коксовый остаток. Этот остаток у дюрэна более связан, но непрочен. При коксовании смеси из 1 части витрэна и 1 частей дюрэна (900°) получают очень плотный кокс, подобный коксу кларэна.
|
|
Витрэн |
Кларэн |
Дюреэн |
Фюзэн |
|
Плотность |
1,23 |
1,22 |
1,47 |
1,52 |
|
Влажность |
9,90 |
8,60 |
6,00 |
3,10 |
|
Зольность |
0,90 |
1,30 |
7,80 |
13,80 |
|
Летучие составные части (на беззольное сухое вещество) |
33,00 |
33,20 |
34,50 |
20,30 |
|
Содержание С (на чистое вещество) |
80,46 |
80,48 |
80,77 |
87,21 |
|
Содержание Н (на чистое вещество) |
5,33 |
5,32 |
4,84 |
3,84 |
|
Содержание О (на чистое вещество) |
11,50 |
11,85 |
12,36 |
7,18 |
|
Содержание N (на чистое вещество) |
1,29 |
1,06 |
1,03 |
0,95 |
|
Содержание S (на чистое вещество) |
1,42 |
1,29 |
1,00 |
0,82 |
|
Содержание α-частей (на чистое вещество) |
85,30 |
- |
92,20 |
- |
|
Содержание β-частей (на чистое вещество) |
10,90 |
- |
4,90 |
- |
|
Содержание γ-частей (на чистое вещество) |
3,80 |
- |
2,90 |
- |
Это – данные анализа одного из английских битуминозных углей (East-Kirkby в Nottinghamshire). Результаты работ английских исследователей (Tideswell, Wheeler, Lessing, Stopes и др.), приведенные выше, не только осветили некоторые процессы образования углей, но имеют также очень большое значение, как для работы угольных топок, так и для сухой перегонки и для газификации углей.
Уголь, как топливо, находит самое разнообразное применение, потому что в нем идеальным образом запасена энергия солнечного света. Прямое сжигание угля в топках (см.) промышленных печей и паровых котлов есть своего рода расточительность, так как при нем значительная часть продуктов сухой перегонки остается не использованной. Но обойтись без него очень трудно, так как колосниковая решетка несет на себе известный запас топлива и является как бы регулятором, поддерживающим непрерывное и равномерное развитие теплоты.
Большая часть мировой добычи ископаемых углей (в 1925 г. — 1 850 млн. тонн) подвергается процессу сухой перегонки на газовых заводах и коксовальнях. Кокс (см. XXIII, 235/36, прил. 28/24, и XLV, ч. 2, 250, 258, 260), получаемый на коксовальнях, различают двух родов — доменный и литейный. Главное различие между ними заключается в их способности окисляться или в их реакционной способности. Под реакционной способностью понимают способность углерода восстановляюще действовать на углекислоту. В доменной печи (см. рис. 3 и 5 в ст. железоделательное производство, XX, 151/52, прил., 25 и 28) часть кокса сгорает у фурм в углекислоту, которая потом, проходя сквозь избыточный кокс, восстановляется в окись углерода. Таким образом, в этом газифицированном состоянии кокс действует на железную руду, косвенным путем восстановляя ее до металлического железа. Многочисленные исследования последнего времени определенно показали, что в этом отношении свойства кокса бывают очень различны. В литейной печи кокс должен по возможности сполна отдавать свою теплоту горения для плавления чугуна. Поэтому литейный кокс должен давать при горении как можно больше углекислоты и как можно меньше окиси углерода. Наоборот, в доменной печи кокс должен обладать способностью быстрого восстановления углекислоты, которая образуется сперва, в окись углерода, на которую потом возлагается задача восстановлять железную руду. Техническое значение различий реакционной способности кокса очень велико. Она играет главную роль во всех процессах газификации. Для определения реакционной способности кокса предложено очень много методов. Укажем здесь на метод Франца Фишера, отличающийся от других простотой и точностью. В основании этого метода лежит следующий принцип. Струю углекислоты постоянной измеренной скорости пропускают через фарфоровую трубку над тонким порошком кокса и улавливают ее в азотометре, наполненном 50% раствором калийной щелочи. Потом температуру фарфоровой трубки постепенно поднимают до тех пор, пока не появится окись углерода, которая, как известно, калийной щелочью не поглощается. Эту температуру и рассматривают, как температуру начинающегося проявления реакционной способности кокса. Для выполнения метода Фр. Фишера предложена соответствующая аппаратура. (О химической переработке каменного угля — сухой перегонке и превращении в жидкое топливо см. XLV, ч. 2, 263/72; о последнем см. также ниже).
Значение угля как топлива можно видеть из следующих цифр. В 1919 г. ожидали, на основании опыта предыдущих лет, от добычи нефти и натурального газа 11,1, от использования энергии воды 5,9 и от добычи угля 171 млн. годовых лошадиных сил.
Второе место по значению как топливо занимают нефть и ее производные (см. XXX, 161'/68'). Для применения нефти как топлива химическое строение ее не имеет значения. Но примеси песка, грязи и воды, а также содержание серы при использовании нефти как топлива не лишены значения. Количество грязи и воды зависит от способа добычи нефти. Эти примеси удаляются уже посредством отстаивания нефти; однако отстаивания бывает недостаточно, если грязь образовала с нефтью род эмульсии. Тогда очистку производят фильтрацией в нагретом слегка состоянии на месте потребления. Смотря по происхождению нефти, содержание серы в ней колеблется от 0,08 до 3%. Европейские нефти содержат серы от 0,08 до 0,35%, американские — до 3%.
Процесс горения является особым случаем окисления, именно — окислением с развитием большого количества теплоты. В продуктах окисления этот процесс дает углекислоту и водяной пар и, кроме того, определенное количество теплоты, которая распределяется, прежде всего, в продуктах горения. Кроме общего процесса горения или, лучше сказать, — прямой топки, следует различать еще процесс горения в моторе. Известно, что двигатель внутреннего сгорания (см.) соединяет по времени и пространству горение и производство работы. Для достижения этого топливо должно быть самым тесным образом смешано с воздухом, и продукты горения, как носители тепловой энергии, должны быть газообразными. Следовательно, чтобы сжигать уголь в двигателе внутреннего сгорания, его надлежало бы вводить в форме тончайшей пыли. В этом кроется первое затруднение. Второе затруднение состоит в зольности угля, но его нельзя считать непреодолимым. Главная же трудность заключается в том, что сгорание частей угля происходит несогласованно. Первая фаза, период сухой перегонки, протекала бы и в моторе, как в прямой топке. Но вторая фаза, горение свободного углерода, никогда не проходила бы вполне, без остатка, потому что отсутствовали бы основные условия: длящаяся высокая температура и продолжительное горение. Много свободного углерода оставалось бы несгоревшим. Использование угля и вообще твердого топлива в двигателе внутреннего сгорания возможно было бы только в той форме, когда газообразование отделяется от горения, как это наблюдаем в газогенераторе и газомоторе, и поэтому Дизель потерпел неудачу с угольной пылью, которую он сперва считал единственным подходящим топливом для своего двигателя. Таким образом, топливом двигателя внутреннего сгорания остается до сих пор только жидкое топливо, по преимуществу нефть и ее производные. Углерод в этом топливе сполна связан с водородом, отчего горение обоих элементов одновременно начинается и одновременно кончается. Многочисленные опыты показали, что всякая нефть или нефтяной продукт, низшая теплотворная способность которых не ниже 10 000 калорий и которые не содержат ни асфальта, ни механической грязи, пригодны как моторное топливо. Впрочем, нельзя сказать, что нефть других качеств будет непригодна. Только тогда придется работу мотора приспособлять для каждого отдельного топлива, что не всегда легко, например, для небольших моторов.
Значительная потребность в низкокипящих погонах нефти — бензине, вызванная громадным развитием движения силовых экипажей, удовлетворяется, помимо простой перегонки нефти, разложением тяжелых нефтепродуктов (ср. XXX, 165'/66'). Еще в 1921 г. в Соединенных Штатах 28% израсходованного бензина были покрыты путем крекинга тяжелых масел.
Под крекингом понимают такого рода распад высокомолекулярных углеводородов, когда происходят легкокипящие углеводороды и совершаются междумолекулярные превращения, связанные с переходом водорода из одной молекулы в другую. При крекинге, кроме низкокипящих продуктов, всегда получают также такие, которые имеют более высокую температуру кипения, чем исходный материал. Современные способы крекинга можно разделить на такие, которые выполняются без помощи катализаторов при атмосферном или при повышенном давлении, и на такие, при выполнении которых пользуются катализаторами вроде хлористого алюминия, железа, селенидов железа и т. д.
По способу давления (способ Burton’а) масло нагревается в особом котле в течение нескольких часов до 130°С при избыточном давлении от 70 до 200 мм водяного столба. Если же в масле присутствуют вода, воздух и другие газы, растворимые в масле, а легколетучие масла отогнаны, то давление поднимают до 5 атмосфер, а температуру нагревания приблизительно до 345°С. По достижении температуры 230—230° содержимое котла закипает, и пары отводятся по наклонно поднимающейся и потом изогнутой в виде колена трубе в водяной холодильник. Низкокипящие части охлаждаются в нем, конденсируются и стекают в общий приемник. Более высококипящие части, напротив, сгущаются уже в приподнятой части трубы и стекают обратно в котел. В приемник поступают только достаточно распавшиеся углеводороды с точкой кипения до 230°С. Сырые бензины содержат растворенными значительные количества постоянных газов. Эти газы удаляются путем очистки давлением и собираются в газометре. Они сжимаются посредством компрессоров высокого и низкого давления и в таком состоянии применяются для поддержания давления в аппаратуре. После того как 50% содержимого котла превратятся в сырой бензин, аппаратура снова переводится на низкое давление, чтобы отогнать газы. Масляные части, отогнанные при дальнейшем разложении, улавливаются отдельно. По окончании процесса и по охлаждении жидкий остаток выливается, и котел подвергается очистке от приставшего кокса. Процесс Buxton’а огнеопасен, так как при нем под давлением нагреваются большие количества масла, и следует опасаться, ввиду накопления кокса на стенках котла, местных перегреваний и разлития масла, которое содержится в котле, через возможные неплотности.
По способу Dubbs’а, масло нагревается в трубчатом змеевике и поступает потом в реакционную камеру, которая для избежания потерь теплоты изолирована. Здесь оно частично испаряется. Не испарившаяся часть (остаточное масло) выливается, охлаждается и применяется потом как топливо. Выделившиеся масляные пары входят во фракционную колонну снизу. Эта колонна накачивается сырым маслом доверху. Масло находится под давлением. Оно воспринимает высококипящие части горячих масляных паров. Образовавшаяся смесь поступает в трубчатый змеевик, нагреваемый до 370°С. Низкокипящие масляные пары осаждаются посредством водяного холодильника и собираются в приемнике, который находится под давлением. Разложение и конденсация происходят под давлением от 8 до 11 атм. Крекинг по способу Dubbs’а дает выход от 60 до 90%. Остаток составляет в среднем 30%, кокс — от 3 до 4%. Неконденсированных газов происходит от 30 до 70 м3/т масла. Теплотворная, способность их составляет от 10 000 до 11 000 кал./м3. Дистиллят в пределах температуры от 45 до 225° составляет от 36 до 60% крекированного масла. Остаточное масло, содержащее твердый углерод, постоянно удаляется, так что опасность образования кокса в аппарате почти устранена.
По способу Blümner’а, который применяется Deutsche Erdöl-Aktiengesellschaft, крекируемое масло течет из сосуда, содержащего запас масла, в смесительный сосуд. Здесь оно смешивается с высококипящими частями масла (которое уже подверглось крекингу), возвращающимися из процесса и перед смешиванием охладившимися в особом аппарате. Посредством насоса смесь подводится в автоклав, который наполнен приблизительно до двух третей расплавленным металлом (например, свинцом). Нагреванием снаружи температура металла держится в пределах от 450 до 500°С. В металл погружено тело, состоящее из колец Рашига. Посредством колец Рашига крекируемое масло, которое вводится снизу, распределяется в металле. Чтобы избежать выделения кокса, масло не допускают до соприкосновения с обогреваемой стенкой автоклава. Но металл может обтекать стенки автоклава и действовать как переносчик теплоты. Продукт крекинга поднимается над расплавленным металлом по трубке в виде жидкого масла. Пар и газ, после автоматической очистки, отводятся в пузырь, который обогревается отходящими газами топки автоклава. Здесь выделяются масла с высокой точкой кипения и асфальт, которые отводятся по трубке в дне пузыря. Кроме того, в пузыре выделяется также кокс. Несгустившиеся пары масла и бензина проходят обратный холодильник (210—220°С). Здесь осаждаются части с высокой точкой кипения и стекают в смесительный сосуд. Остальные пары масла проходят в змеевиковый холодильник, где они сгущаются в бензин. Бензин течет в бензиновую цистерну. Часть, не подвергшаяся конденсации, используется в топке автоклава. Теплотворная способность ее достигает 14 000 кал./м3. Каждая установка работает посредством двух автоклавов, которые вводятся параллельно. Одна такая установка дает ежедневно 8 т бензина. В бензин может переводиться до 70% крекируемого масла.
Способ Bergius’а испытывался в течение нескольких лет на большой опытной установке в Ренау. Bergius крекирует действием водорода под давлением. Уже более десяти лет тому назад он пытался получить разжижение ископаемого угля путем искусственного присоединения водорода к углероду. При исследовании строения ископаемого угля, также как и при опытах искусственного получения этого угля, наблюдалось, что искусственный уголь может содержать от 85 до 88% углерода, химически связанного с водородом. Именно, при давлении в 200 атм. и при температуре в 450°С этот уголь может воспринять такое большое количество водорода, что вполне переходит из твердого состояния в жидкое, образуя жидкость, которая походит на сырой керосин. Таким образом, обнаружилась возможность измолотый уголь превращать в жидкое топливо, хотя процесс этот продолжителен, так как уголь даже в очень измельченном состоянии вое еще представляет твердое тело и не легко приводится в близкое прикосновение с водородом, как это наблюдается с жидкостями (ср. XLV, ч. 2, 270).
Опытная установка для гидрирования масел по Bergius’у занимает приблизительно 8 куб. м и позволяет перерабатывать в год около 18 000 т сырого масла. Аппарат состоит из двух горизонтальных цилиндров, вдвигаемых один в другой. Крекируемое масло, смешанное с водородом, поступает во внутренний цилиндр, в котором держится давление от 120 до 180 атм. В наружном цилиндре протекает азот, давление которого автоматически поддерживается приблизительно на 0,6 атм. выше, чем во внутреннем цилиндре. Нагревание производится азотом, который в свою очередь нагревается приблизительно до 500°С снаружи аппарата змеевиком, погруженным в свинцовую баню. Изменением температуры и скорости течения азота может быть достигнуто точное поддерживание температуры. Отходящие горячие продукты реакции подогревают в особом аппарате азот, идущий из свинцовой бани. Точно таким же образом может быть нагреваем и водород, нагнетаемый во внутренний цилиндр. Движение азота производится посредством насоса, который соприкасается только с холодным газом. Подобным же образом движется водород и сырое масло. Помещенный на таком сосуде мотор Desсhleg’а производит то, что из аппарата могут выходить только легкокипящие части, тогда как части, которые недостаточно «бергинизированы», возвращаются назад. По способу Bergius'а, масла, богатые асфальтом, испытывают крекинг при нагревании от 380 до 450° и при одновременном гидрировании, так что образование кокса устраняется и потеря в виде перманентных газов бывает много меньше, чем при других методах. В то время как при обыкновенном крекинге происходит до 8% кокса и до 14% газов, по методу Bergius’а то же самое масло дает газов только 3—4% и совсем не дает кокса.
В настоящее время Bergius’oм уже решен вопрос о непрерывном способе производства, при котором, с одной стороны, вводится измельченный уголь, а с другой стороны — отводятся продукты реакции. Чтобы иметь возможность ввести уголь в аппаратуру, он смешивается с густым маслом. Для этого применяются остатки каменноугольной смолы, т. е. остатки, получаемые после отгонки от смолы низкокипящих составных частей. Из 100 кг верхнесилезского пламенного угля, содержащего 28% летучих составных частей, было получено: 55 кг маслянистого вещества, 15 кг газов, 10 кг воды, 6 кг золы, 13,5 кг неизмененного угля, 0,5 кг аммиака. 55 кг масла состояли из 22 кг нейтральных масел, кипящих до 230°С (следовательно без фенолов), далее из 17 кг частей, кипящих выше 230°, и фенолов и, наконец, из 18 кг пека. Полученный газ состоял главным образом из метана. Здесь приведены средние числа. Т. о., из 2 кг угля можно получить, по крайней мере, 1 кг масла. При более молодом угле результаты еще благоприятнее. Например, из одного такого угля получено было 70% масла.
По мнению Bergius’а, для выполнения его способа препятствий более нет, так как в настоящее время имеется аппаратура для высоких давлений, с которой можно хорошо работать. Реакция протекает очень быстро, приблизительно в 10 минут. Дешевым источником водорода, который необходим для гидрирования, является коксовальный газ. Этот газ в последние часы работы коксовой печи содержит до 60% свободного водорода.
О получении жидкого топлива из газов см. ХLV, ч. 2, 271/72.
О торфяном топливе см. торф.
О дровяном топливе см. дрова.
Теплота находится в топливе в виде связанной анергии, которая освобождается при горении (ср. термохимия, XLI, ч. 7, 574/77). Количество теплоты, которое выделяется при горении 1 кг твердого или жидкого топлива, или 1 куб. м газообразного топлива, называется теплотворной способностью. Если вода в продуктах горения мыслится в жидком состоянии, то теплотворную способность называют высшей, если в парообразном — то низшей. Лучшую характеристику топливо дает не теплотворная способность его, но его теоретическая температура горения. Чтобы составить понятие об этой температуре, следует представить себе, что горение топлива совершается в бесконечно малом объеме и в бесконечно малое время, следовательно, не происходит потери теплоты лучеиспусканием наружу и внутри пламени вследствие диссоциации. Теоретическая температура вычисляется из уравнения:
![]()
где Q — теплотворная способность топлива; Q1 — теплосодержание топливо, если оно подогрето; Q2 — теплосодержание подогретого воздуха; ∑х — количества продуктов горения; Срх — средняя удельная теплоемкость продуктов горения при постоянном давлении; t — теоретическая температура. Что касается определения теплотворной способности топлива, то оно или производится опытным путем, именно, сжиганием навески топлива в бомбе калориметра, или вычислением. Вычисление чаще всего выполняется по способу Дюлонга и Пти, в основу которого кладется следующее положение: теплотворная способность топлива равна сумме теплот горения углерода, водорода и серы, входящих в состав топлива. Если через С, Н, О и S назовем весовое содержание в топливе углерода, водорода, кислорода и серы в процентах, то теплотворная способность одного килограмма топлива U будет
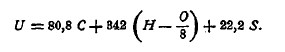
Если желают определить низшую теплотворную способность, то из этой суммы должны вычесть теплоту, израсходованную на образование пара, именно, — число 6, помноженное на влажность топлива. Коэффициентом при (Н – О/8) в предыдущем уравнении надо взять число 287. Следует иметь ввиду, что Дюлонг и Пти делают предположение, что весь кислород топлива связан с водородом его в воду. Следовательно, сгорает только так называемый свободный водород. Если, например, топливо содержит Н% и О%, водорода и кислорода, то количество свободного водорода, т. е. не связанного в воду, выразится величиной (Н – О/8)%. Эта величина и вводится в расчет. Опытами установлено, что 1 килограмм углерода (С) при сгорании в углекислоту (СО2) выделяет 8 080 калорий, а при сгорании в окись углерода (СО) только 2 473 калории; 1 килограмм водорода (Н2) выделяет при сгорании в жидкую воду 34 200 калорий, а в водяной пар — 28 700 калорий; 1 килограмм серы (S) при сгорании до сернистой кислоты (SO2) дает 2 220 калорий. Для определения теплотворной способности газообразного топлива пользуются особым калориметром, обыкновенно калориметром Юнкерса. Вычисление теплотворной способности в этом случав производят на основании теплотворной способности составных частей газовой смеси. При этом принимают, что 1 куб. метр окиси углерода (СО) дает при сгорании 3 000 калорий, 1 куб. метр водорода (H2) выделяет 2 560 калорий, 1 куб. метр метана (СН4) дает 8 600 калорий, 1 куб. метр этилена (С2Н4) дает 14 000 калорий.
У нас в настоящее время теплотворная способность топлива определяется, с пересчетом на рабочий состав, по правилам, которые установлены IIІ Всесоюзным теплотехническим съездом. Различаются:
1) «теплотворная способность по бомбе» — получающаяся по тепловыделению в бомбе с поправками на охлаждение и горение железной проволоки;
2) «высшая теплотворная способность» — получается по тепловыделению в бомбе с поправками на охлаждение, горение железной проволоки, серную и азотную кислоту;
3) «низшая теплотворная способность по бомбе» — отличающаяся от указанной в п. 1) введением поправок на образование водяного пара;
4) «низшая теплотворная способность» — получается по указанной в п. 2) введением поправок на образование водяного пара.
За исходную величину принимается теплотворная способность, определенная в калориметрической бомбе при 20°С с указанными в п. 2) поправками. С практически достаточной точностью можно принять, что высшая теплотворная способность при сгорании при постоянном давлении и заданной температуре равна этой величине.
Для подсчета низшей теплотворной способности при постоянном давлении, впредь до дальнейших уточнений, можно пользоваться общепринятой формулой:
![]()
Здесь QPH — низшая теплотворная способность рабочего топлива, QPВ — высшая теплотворная способность рабочего топлива, НР и WP — содержание водорода и влаги в рабочем топливе в %%.
Теплотворная способность газообразного топлива дается в калориях на 1 куб. м при 0° и 760 мм ртутного столба.
В основу расчетов кладется параллельно и высшая и низшая теплотворная способность, отнесенная к рабочему составу топлива.
Горючая часть твердого и жидкого топлива состоит, главным образом, из углерода и водорода, которые входят в состав топлива в виде углеводородов. При полном сгорании углерод сгорает с кислородом топлива и подводимого атмосферного воздуха в углекислоту. Реакция горения выражается уравнением, в котором молекулярные веса взяты в килограммах:
12 кг С + 32 кг О2 = 44 кг CO2.
Принимая во внимание, что молекулярные веса всех газов при одинаковых температуре и давлении занимают равные объемы, именно, 22 4 куб. м при 0° и давлении в 760 мм, получим уравнение:
12 кг С + 22,4 куб. м О2 = 22,4 куб. м CO2
или на 1 куб. метр кислорода:
0,536 кг С + 1 куб. м O2 = 1 куб. м CO2.
Следовательно, из 1 объемной части кислорода получается 1 объемная часть углекислоты. Таким образом, на 0,586 кг углерода необходимо для горения 1:0,21 = 4,8 куб. м воздуха или на 1 кг углерода 4,8:0,536 = 8,9 куб. м воздуха.
Водород сгорает по уравнению:
2 кг H2 + 11,2 куб. м O2 = 22,4 куб. м H2O (пар).
Дымовые газы от горения чистого водорода при объемном газовом анализе дают только азот, при условии, что весь кислород воздуха, подведенного в теоретическом количестве, соединился с водородом.
Горение окиси углерода идет по уравнению:
22 4 куб. м СО + 11,2 куб. м O2 = 22,4 куб. м CO2.
Горение углеводородов протекает по уравнению (ср. XLI, ч. 7, 574):
![]()
В приведенных уравнениях горение совершается с теоретическим количеством воздуха. На практике, однако, горение всегда протекает с некоторым избытком воздуха. Пусть L — теоретическое количество воздуха, L1 — практически необходимое. Отношение L1/L = λ называется коэффициентом избыточного воздуха, отношение L/L1 = η — называется воздушным множителем и отношение 100(L1 – L)/L = α — выражает избыток воздуха в процентах.
λη = 1; α = (λ – 1)100 = (1/η – 1)100.
Легко видеть, что λmax = ∞ соответствует ηmin = 0;

Нормальным принято считать такой коэффициент избыточного воздуха, при котором достигают в топке самой высокой температуры горения. Для каждой топки он определяется путем опыта. См. топки.
С. Флоров.
| Номер тома | 41 (часть 8) |
| Номер (-а) страницы | 412 |
