Цианистые соединения
Цианистые соединения (или синеродистые соединения), содержащие группу CN, представляют большой теоретический и практический интерес, очень многочисленны и разнообразны и образуют хорошо очерченную группу. Углерод и азот в ней связаны несколькими единицами сродства (валентности). Строение радикала CN может быть или — CN, или — NC. В первом, случае N трехвалентен, углерод четырехвалентен и группа — СN соединяется с элементом или радикалом посредством сродства углерода. Во втором сродство принадлежит азоту, и одни признают азот пятивалентным:
![]()
другие и здесь считают N трехвалентным, но признают ненасыщенный (или двухвалентный) углерод
![]()
Простейшими цианистыми соединениями являются HCN, MCN (М-металл), (CN)2, XCN (X- галоид, ОН, NH2, SN). Эти соединения известны, каждое в виде одного изомера. Но для продуктов замещения водорода в HCN, HCNS на радикалы известно по два ряда (см. таутомерия). 3аключая группу CN, в которой атомы связаны многократной связью, цианистые соединения обладают непредельным характером: они способны к разнообразным реакциям присоединения и проявляют очень резко выраженную склонность к полимеризации и изомеризации. Простейшие цианистые соединения могут быть получены из элементов, и по характеру группа CN во многих отношениях напоминает галоиды. Из цианистых соединений особо широкое применение находят KCN и NaCN; обе соли употребляются в технике для извлечения золота из россыпей в гальваностегии и гальванопластике. Большинство простейших цианистых соединений представляют сильнейшие яды.
Исходными продуктами для приготовления разнообразных цианистых соединений служат или т. н. желтая кровяная соль (железисто-синеродистый калий) K4Fe(CN)6, или цианистые металлы. Желтая кровяная соль добывается или нагреванием сушеной крови, шерсти, роговых обрезков с поташом и железными опилками, или из массы для очистки газа (Ляминговой массы). Цианистые металлы получаются при взаимодействии азота воздуха с карбидами (Са или Ва) или при нагревании азотистых металлов с углем. Исходным материалом служат известь, углекислый барий или поташ, уголь и азот воздуха. Получение цианистого бария слагается из двух процессов: образование карбида — реакция эндотермическая и соединение последнего с азотом — реакция экзотермическая, идущая по уравнению:
![]()
Карбид кальция с азотом дает в тех же, приблизительно, условиях кальций-цианамид:
![]()
Из синеродистого бария или прокаливанием желтой кровяной соли, одной или с поташом, получают синеродистый калий по уравнениям:
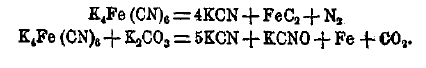
В настоящее время, для получения цианистых K и Na разложением желтой соли, нагревают ее с натрием в закрытых чугунных тиглях:
![]()
Получается продукт, состоящий на 1/3, из NaCN, очень богатый CN. Расплавленную массу отделяют от Fe, пропуская ее в накаленном сосуде через фильтрующий слой под давлением. Цианистый натрий получается также при действии газообразного NH3 на смесь металлического натрия и угля (в расплавленном NaCN) в результате таких реакций:
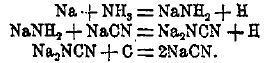
Простейшие цианистые соединения были исследованы особенно Гей-Люссаком, получившим свободный циан (CN)2, который считали тогда за радикал (см. химия органическая), безводную HCN и многие их производные.
Синильная кислота HCN может быть получена действием серной кислоты на K4Fe(CN)6 или KCN. Безводная представляет бесцветную подвижную жидкость, температура кипения +26,5°, удельный вес 0,7, температура плавления —15°. Чрезвычайно сильный яд. Встречается в растениях: горьком миндале, косточках вишни, абрикосов, листьях лавровишни и пр. в виде глюкозидов. В очень разведенном растворе применяется в медицине. Кислота очень слабая и непрочная; в водном растворе разлагается, превращаясь в муравьино-кислый аммоний, и потому представляет нитрил этой кислоты:
![]()
При восстановлении дает метиламин CH3NH2. Со снованиями дает соли. Щелочные соли KCN, NaCl кристалличны и растворимы в воде; в спирте не растворимы; на этом основан способ получения чистого KCN пропусканием HCN в спиртовой раствор чистого КОН:
![]()
Соли тяжелых металлов нерастворимы в воде (исключение Hg(CN)2), но способны образовать растворимые двойные соли, например, KAu(CN)2. Эта соль образуется при действии раствора KCN на металлическое золото в присутствии кислорода по уравнениям;
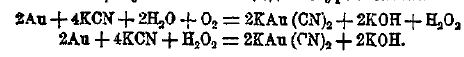
Эти реакции имеют место при извлечении посредством KCN золота из россыпей. Кроме двойных солей, известно много комплексных солей. Эти соли характеризуются тем, что в них металл (тяжелый) в соединении с цианом образует особый сложный радикал. Наиболее важны из комплексных солей железисто-синеродистый и железосинеродистый кадий, или желтая и красная кровяные соли:
![]()
Первая соль кристаллизуется с ЗН2О в виде крупных желтых кристаллов, безводная, белый порошок; вторая — буровато-красные призмы. Обе соли производятся от соответствующих комплексных кислот и способны переходить одна в другую; так, вторая может быть получена из первой при действии окислителей, например хлора, и сама может служить окислителем, причем переходит в первую. Обе служат реактивами на соли железа; первая с солями окиси дает синий осадок берлинской лазури, вторая с солями закиси дает тоже синий осадок турнбуллевой сини (ср. железо, XX, 147):

Известны и более сложные комплексные соли; примером может служить нитропруссидный натрий:
![]()
С сернистыми металлами щелочей соль эта даст калиновое окрашивание.
Циан, или синерод. Как галоидоводородам отвечают свободные галоиды (молекула из двух атомов), так синильной кислоте (HCN) отвечает циан (CN)2 или Су2. Циан может быть получен из элементов, но обычно получается следующими способами: нагреванием сухой цианистой ртути — Hg(CN)2 = Hg + (CN)2 или действием синеродистого калия на раствор CuSО4 по уравнению:
![]()
эта реакция вполне аналогична действию KJ на CuSО4, причем получается J2. Циан может также быть получен отнятием воды от щавелево-аммиачной соли и потому представляет нитрил щавелевой кислоты. Циан (название от κυανός — стально-синий) бесцветный, ядовитый газ, температура кипения — 20,7°, температура плавления — 34,4°. Образуется с большим поглощением тепла из элементов 2С (графит) + N2 = C2N2 — 71,5 калорий; поэтому пламя его горячо. Пламя горящего циана окрашено в малиновый цвет. Циан легко полимеризуется в твердый парациан.
Галоидные соединения циана общей формулы XCN (где X означает хлор, бром или иод) представляют летучие, кристаллические (CICN — газ) ядовитые вещества, склонные полимеризоваться в соединения утроенной формулы. Они могут быть получены действием галоидов на цианистые металлы, например:
![]()
Цианамид. В мономерной форме NH2CN может быть получен из галоидных соединений при действии аммиака, или из роданистого аммония отнятием H2S окисью ртути, или, наконец, действием кислот на металлические его производные — натрий или кальций цианамид. Кальций-цианамид CaNCN приготовляется в широких размерах, по Франку и Каро, пропусканием азота через нагретый до красного каления карбид кальция — реакция, представляющая один из важнейших методов связывания атмосферного азота. CaNCN широко применяется в качестве удобрения и для приготовления других азотистых соединений. Свободный цианамид (мономер) NH2CN —бесцветные кристаллы, плавящиеся при 40°. Он иногда реагирует в форме
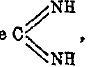
, легко полимеризуется в дициандиамид (NH2CN)2 — пластинки, плавятся при 250°С, и вообще способен к разнообразным реакциям.
Циановая кислота и ее соли. Получается превращением в пар полимеров, например, C3H3N3О3 циануровой кислоты, и сильным охлаждением пара — в виде бесцветной, подвижной жидкости с резким запахом. Выше 0° быстро (со взрывами) превращается снова в полимеры. Водой циановая кислота быстро разлагается:
![]()
почему не может быть получена действием кислот на соли. Щелочные соли постоянны при красном калении и образуются присоединением кислорода к циановым солям при сплавлении последних с РbО или другими окислами (МnО2) или окислении хамелеоном:
![]()
Таким образом, при высокой температуре циановые соли являются сильными восстановителями. Циановокислый аммоний при нагревании изомеризуется в мочевину
![]()
реакция обратима. Это — знаменитый синтез Вёлера (см. химия органическая). При растирании KCNО с кристаллической щавелевой кислотой образуется циамелид — С3H3N3О3 — рыхлый, белый порошок, трудно растворимый; в нем три группы CHNО связаны кислородом, как, например, в паральдегиде.
Циануровая кислота C3H3N3О3 образуется при нагревании мочевины или, лучше, при пропускании хлора в расплавленную мочевину. Дает производные от энольной (II) и от кетонной (I) формы:
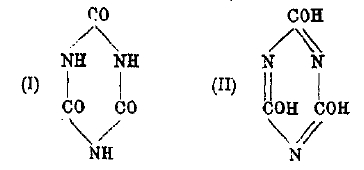
Известны соли (галоидангидриды), амиды, эфиры и пр. производные циануровой кислоты. Все эти соединения относятся к азотистым гетероциклам.
Роданистоводородная кислота HCNS и ее соли отличаются по составу от циановой тем, что вместо кислорода содержат серу. Простейший способ получения солей — сплавление с серой цианистых солей, например, KCN + S = KCNS. Щелочные соли и соли аммония кристалличны и чрезвычайно легко растворимы в воде с сильным охлаждением. Соль окиси железа в растворе ярко красного цвета — чувствительная реакция на Fe. Соль серебра — белый творожистый осадок, нерастворимый в слабой азотной кислоте (пользуются при объемном определении Ag и Сl по Фольгардту). Роданистая ртуть при горении оставляет чрезвычайно объемистый осадок (C,N,S) (фараоновы змеи). Свободная HCNS при 0° представляет кристаллическую, бесцветную массу с сильно едкими свойствами; легко растворяется в воде, но в растворе скоро переходит в полимеры (H2C2N2S2 и H3C3N3S3). Последний отвечает циануровой кислоте. Роданисто-водородная кислота довольно сильная. Известен и радикал ее — родан C2N2S2 — кристаллы, теплота плавления — 2,5°. При обыкновенной температуре быстро разлагается.
Органические производные HCN, HCNО и HCNS. Как сказано выше, для каждой из двух таутомерных форм этих соединений известны два ряда производных (от HCNO пока хорошо изучен один ряд). Н—C=N отвечают нитрилы (см.); так называют соединения, получающиеся из аммонийных солей отнятием воды, например:
![]()
Так как этим путем в частицу органического соединения можно ввести группу CN, то метод цианистых соединений является одним из важнейших методов синтеза органических кислот. При нагревании до 250° в нитрилы переходят изонитрилы (см. карбиламины). Двухосновные кислоты способны давать полные и неполные нитрилы. Так, малоновой кислоте отвечает ее нитрил: полный
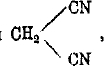
температура плавления 30°, температура кипения 218°С, и неполный — цианоуксусная кислота CH2CNCООH, получаемая из хлороуксусной киолоты и KCN:
![]()
CH2CNCOOH плавится при 70°, около 165° разлагается на CH3CN и СО2.
Цианоуксусный эфир CNCH2CООC2H5 кипит при 207° и находит применение для синтезов (подобно малоновому эфиру), т. к. водород группы СН2 способен замещаться натрием, а этот последний может обмениваться на разные радикалы при действии галоидных производных, например:
![]()
Изоциановые эфиры получаются: действием окиси ртути на карбиламины, например:
![]()
при действии иодюров на СО = NAg, например:
![]()
и пр. Реакции изоциановых эфиров доказывают их строение: так, при действии щелочей при нагревании они разлагаются на K2СО3 и первичные амины, например:
![]()
таким путем Вюрц и приготовил впервые метил- и этил-амины. С аммиаком и аминами изоциановые эфиры образуют замещенные мочевины, например:
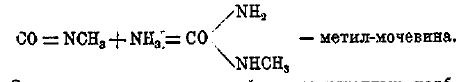
Со спиртами получаются эфиры замещенных карбаминовых кислот (см.), т. н. уретаны, например:
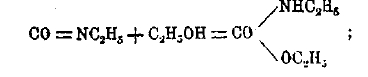
т. к. последние соединения обычно кристалличны, то изоциановыми эфирами (особенно CONC6H5) часто пользуются для характеристики и выделения спиртов из смесей с другими соединениями. Изоциановые эфиры представляют летучие жидкости и на основании приведенных и других реакций отвечают карбимиду СО = NH, т. е. имиду углекислоты.
Нормальные циановые эфиры - RОCN пока неизвестны, но для циануровой кислоты известны два ряда эфиров: С3О3N3R3 и R3О3C3N3. Родановой кислоте HSCN отвечают два ряда эфиров, хорошо изученных: горчичные масла (см.), отвечающие изоциановым эфирам формулы CS=NR, и настоящие родановые эфиры формулы RSC = N, отвечающие неполученным цианоновым эфирам RОCN. Родановые эфиры получаются или действием иодюров на роданистый калий, например:
![]()
или действием на меркаптиды CNCl, например:
![]()
Так как при восстановлении родановых эфиров получаются меркаптаны, а при окислении — сульфокислоты, то радикал в них связан с серой. При нагревании CNSCH3 (кипит при 133°) переходит в соответствующее горчичное масло CSNCH3 (температура плавления 34, температура кипения 119°). Аллильный эфир еще легче переходит в аллиловое горчичное масло. Известны тионуровые кислоты C3H3S3N3 и их производные.
См. Н. Е. Williams, «The Chemistry of cyanogen Compounds», London, 1915; W. Moldenhauer, «Die Reactionen des freien Stickstoffs», Berlin, 1920.
Н. Демьянов.
| Номер тома | 45 (часть 3) |
| Номер (-а) страницы | 401 |
