Циклические углеводороды
Циклические углеводороды СnН2n (циклопарафины) наиболее предельны; в них нет кратных связей. Их называют полиметиленовыми и производят от простейших членов, циклы которых образованы только группами СН, — метиленовыми, откуда и название. Простейшие представители:
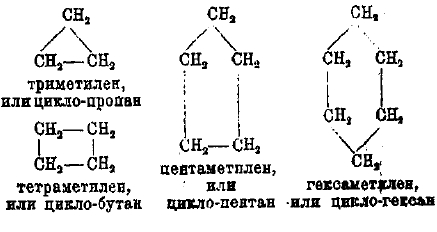
Известны и полиметилены из семи, восьми (и девяти) групп СН2.
Замещая в этих исходных кольцах водород на предельные радикалы, получаем ряды гомологов. Названия их слагаются из названия радикалов, числа их, относительного положения и названия цикла. Например,
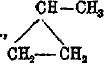
метилциклопропан и т. д. Здесь возможны многочисленные случаи изомерии: структурной, стереоизомерии геометрической и оптической (ассиметрический атом углерода и ассиметрия частицы).
Самыми общими способами получения являются восстановление (каталитическое) более непредельных углеводородов и переход к углеводородам от циклических кетонов, через спирты и галоидные производные. Физические свойства циклических соединений отличаются от свойств соответствующих (по числу атомов углерода) углеводородов предельных и этиленовых. Так, удельный вес полиметиленовых углеводородов больше, температура кипения выше; для производных триметилена инкремент (превышение над вычисленным) молекулярной рефракции (MR) около 0,66—0,7, для производных тетраметилена он около 0,45 (в среднем). Это относится и к их производным.
Реакции присоединения, даже у циклопропана, идут гораздо труднее, чем у этиленовых углеводородов, требуют нередко особых условий (света и пр.), для циклобутана они еще более затруднены, а циклопентан и циклогексан к ним уже неспособны. Гомологи циклопропана более склонны к реакциям присоединения, чем триметилен (Демьянов). Хамелеон (водный раствор) на триметиленовые и тем более на другие полиметиленовые углеводороды не действует. Реакции замещения идут немного легче, чем с предельными углеводородами.
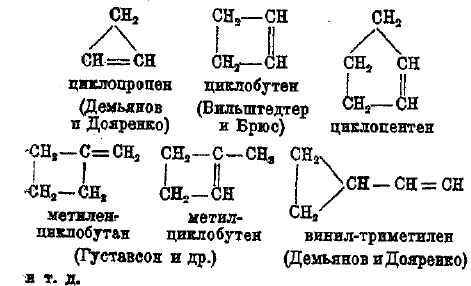
Углеводороды ряда CnH2n-2 могут заключать цикл в двойную связь или два цикла (бицикличѳ- окне). Двойная связь может быть или в цикле, или в боковой цепи. Простейшие представители этих углеводородов:
Что касается бициклических углеводородов, то простейшие возможные члены
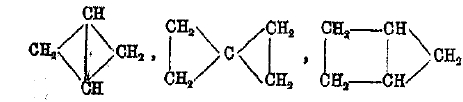
еще не получены, более сложные, каковы, например,
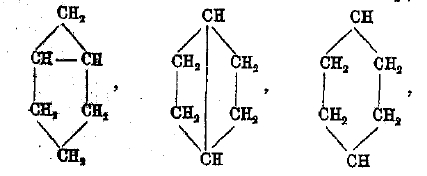
приготовлены недавно (Зелинский, Успенский). Последний обладает необыкновенными свойствами и признается Н. Д. Зелинским за свободный радикал. Бициклические и даже трициклические группировки очень распространены среди терпенов.
В ряду углеводородов СnН2n-4, к которым относятся терпены C10H16 (см. терпены), особый интерес представляют производные углеводорода:
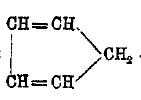
циклопентадиена, носящие название фульвенов (от fulvus — желтый) по причинам свойственной им желтой или красноватой окраски. Циклопентадиен кипит при 41°, находится в каменноугольной смоле, очень легко окисляется и полимеризуется в (С5Н8)2 и более сложные полимеры. Водород группы СН, может замещаться на калий (соединение это загорается на воздухе) и на радикалы; последнее происходит при действии альдегидов и кетонов, например:
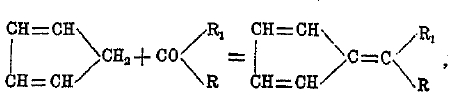
причем получаются фульвены. Соответствующие производные циклогексана, т. н. циклогексадиены и их гомологи, стоят в близком отношении к ароматическим углеводородам, - например, циклогексадиен к бензолу, и получены Байером, например
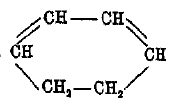
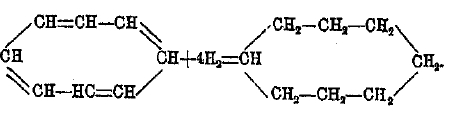
Из более непредельных циклических углеводородов большой интерес представляет циклооктотетраен C8Н8, полученный Вильштедтером. Несмотря на то, что в кольце этого углеводорода 8 групп СН и чередуются двойные и простые связи, как в бензоле (формула Кекуле), он совершенно не обладает ароматическим характером; напротив — это типичный ненасыщенный углеводород (энергично присоединяет Вr, окисляется раствором KMnO4). При каталитическом восстановлении переходит в циклооктан:
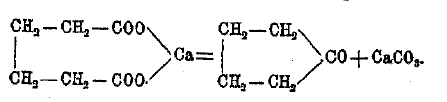
Производные циклических углеводородов известны в большом числе. Циклические соединения представляют мало особенностей по сравнению со свойствами соответствующих соединений с открытыми цепями. Весьма хорошо изучены кислоты различной основности с трех- и четырехчленными циклами, получающиеся действием дибромидов на натр-малоновый, натр-цианоуксусный эфиры, а также другими способами. Циклические кетоны с пяти- шести-членными и больше (даже с 16 и больше) циклами, получаются при сухой перегонке кальциевых солей двухосновных кислот, например:
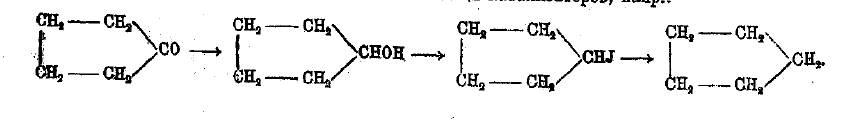
От кетонов можно перейти к спиртам, углеводородам, аминам и другим производным, частью при помощи катализаторов, например:
Изомеризация циклических соединений происходит под влиянием тех же факторов, которые вызывают и изомеризацию соединений с открытыми цепями: повышенная температура, особенно в присутствии катализаторов (Al2O3, Pt и др.), крепкие кислоты, — например, HJ, H2SO4 и даже щавелевая кислота, — и, наконец, азотистая кислота при действии на амины, или AgNO2 при действии на иодюры. Направление процессов изомеризации может идти, как в сторону увеличения цикла, так и в сторону уменьшения, причем особая наклонность проявляется к образованию и переходу в пяти- и шестичленные циклы. Изомеризация обычно всегда идет так, что цикл из n атомов углерода с боковой цепью переходит или в цикл с n+1 или n—1 атомами углерода.
Наиболее общая закономерность в этой области состоит в том, что при действии азотистой кислоты на циклические амины с n атомами углерода в цикле и боковой цепью CH2NH2 образуются нормально первичный алкоголь и (иногда главным образом) вторичный изомерный, содержащий n + 1 атомов углерода в цикле (Демьянов), например:
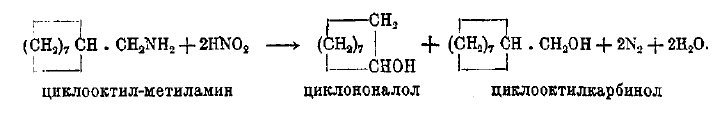
В некоторых случаях удалось обнаружить, что, если исходить из аминов с группой NH2 в цикле, то реакция приводит (отчасти или сполна) к алкоголю с меньшим циклом или двойной связью; так,
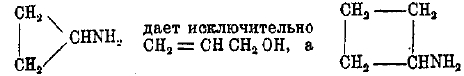
смесь спиртов с трех- и четырехчленными циклами. Впоследствии удалось обобщить эту реакцию и показать, что согласно вышеприведенным правильностям протекает и изомеризация спиртов под влиянием кислот (Демьянов, Н. М. Кижнер и др.) или при пропускании через нагретую до 300—400° АІ2О3 (Дояренко). Не все циклы одинаково прочны, одинаково легко образуются, и поэтому не все циклические соединения одинаково распространены в природе. Пяти- и шестичленные циклы в виде полиметиленовых и ароматических углеводородов распространены особенно широко. Некоторые сорта нефти (бакинская и др.) состоят, главным образом, из гексаметиленовых углеводородов и пентаметиленовых (т. н. нафтены). Во всех терпенах содержится шестичленное кольцо, иногда, кроме того, пяти-, четырех- и трехчленные. В свободном виде последние кольца в природе не найдены. В последнее время показано, что среди природных соединений некоторые содержат циклы из большего числа атомов углерода, например, цибетону С17Н30О, кетону, содержащемуся в мускусе, придают формулу
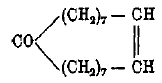 с семнадцатичленным циклом.
с семнадцатичленным циклом.
См. Aschan, «Alizyclische Verbindungen», 1905; В. Т. Brooks, «The chemistry оf the non-benzenoid Hydrocarbons», 1922; S. Nametkin, .Die Umlagerung alizyeliseher Kerne ineinander», 1925; Б. H. Меншуткин, «Карбоциклические соединения», 1926; А. Е. Успенский, «Основания стереохимической теории изомерных превращений», Изв. Института чистых химических реактивов Н. Т. О., 1923 и пр.
Н. Демьянов.
| Номер тома | 45 (часть 3) |
| Номер (-а) страницы | 414 |
