Углекислота
Углекислота, углекислый газ, угольный ангидрид, двуокись углерода, различные названия одного и того же вещества, состоящего из углерода и кислорода и изображаемого химической формулой СО2. При обыкновенной температуре и давлении вещество это есть газ без цвета и запаха. Плотность его по отношению к воздуху 1,52909 (лорд Релей), один литр его при 0°С и 760 мм давления весит 1,977414 г. Критическая температура его 30,92°С, поэтому при комнатной температуре он легко сгущается в жидкость при увеличении давления. Упругость насыщенного пара жидкой углекислоты в зависимости от температуры определяется следующими данными:
|
Температура, °С |
Упругость в атмосферах |
|
-59,4 |
4,6 (Фарадей) |
|
-20,0 |
23,6 (Мареска и Донни) |
|
-15,0 |
25,3 (Мареска и Донни) |
|
0,0 |
36,0 (Мареска и Донни) |
|
+10,0 |
46,0 (Мареска и Донни) |
|
+19,0 |
57,0 (Мареска и Донни) |
При температуре ниже — 60° жидкая углекислота кристаллизуется в снежно-белую массу — твердую углекислоту, упругость насыщенного пара которой в зависимости от температуры выражается следующими данными:
|
Температура, °С |
Упругость в атмосферах |
|
-63,9 |
3,60 |
|
-70,5 |
2,28 |
|
-77,2 |
1,36 |
|
-99,4 |
1,14 |
Таким образом, жидкая углекислота при давлении, меньшем 5 атмосфер, существовать не может и превращается в твердое состояние. Поэтому, когда жидкую угольную кислоту из стальных резервуаров, в которых она поступает в продажу, выпускают на воздух, то она сильно испаряется и превращается в твердое состояние, причем температура получаемой снежно-белой массы понижается до —100°С. В этом виде твердая углекислота сохраняется продолжительное время, так как испарение ее идет очень медленно. Такие свойства твердой углекислоты делают ее чрезвычайно удобной для искусственного получения сильного холода. Обыкновенно для этой цели снегообразную углекислоту смешивают с серным эфиром и таким образом получают кашеобразную массу, очень удобную для обращения, температура такой смеси держится около—80°С.
Углекислота при обыкновенных давлениях и температурах показывает значительные отступления от законов Бойля-Мариотта и Гей-Люссака. Граммолекула ее (44 г) при 0° и 760 мм давления занимает объем 22,26 литра (вместо нормальной величины 22,42 литра).
Углекислота значительно растворима в воде и спирте, как это видно из следующей таблицы, показывающей, сколько объемов этого газа растворяется в одном объеме воды и спирта:
Температура. Вода. Спирт.
0° . . 1,7977 . . 4,3295
10° . . 1,1847 . . 3,5140
15° . . 1,0020 . . 3,1993
20° . . 0,9014 . . 2,9465.
Теплоемкость углекислоты сильно изменяется с изменением температуры. По определениям Реньо, средняя теплоемкость при постоянном давлении выражается следующими данными:
Между + 10° и + 100° . . . Ср. = 0,20246
« + 10» и + 200° . . . Ср.= 0,21692.
Определение теплоемкости для более высоких температур было произведено Ле-Шателье и Маляром (1884), Гольборном и Геннигом (1907) и М. Пиром (1909). По этим новейшим определениям, средняя молекулярная теплоемкость углекислоты, отнесенная к одной граммолекуле (44 г), между 0°С и t° при постоянном давлении выражается следующими формулами:
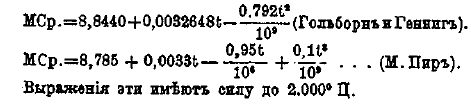
Выражения эти имеют силу до 2 000°С.
При образовании одной граммолекулы (44 г) углекислоты из аморфного углерода (12 г) и кислорода (32 г) выделяется 97 660 малых калорий (Бертло).
Первые сведения об углекислоте, как об отличном от воздуха газе, дал еще в XVII в. Ван-Гельмонт. Затем в ХVIII в. Кавендиш, Пристли и Блек сделали ряд важных исследований над этим газом. Истинная природа и точный химический состав его были установлены Лавуазье.
В природе углекислота находится в свободном состоянии в атмосферном воздухе и в растворенном состоянии во всех природных водах, как пресных, так и соленых. В воздухе содержание углекислоты колеблется в довольно узких пределах и в среднем принимается в 0,03% по объему или 0,046% по весу по отношению к сухому воздуху (см. атмосфера, IV, 240/43).
В природе существует целый ряд процессов, выделяющих и в атмосферу углекислоту, таковы, например: 1) процессы, связанные с вулканической деятельностью земной коры (см. вулканы, XI, 636/36); 2) процессы, связанные с гниением, брожением и разложением органических веществ на земной поверхности (см. брожение, VI, 681); 3) процессы, связанные с сжиганием топлива. Как известно, все виды нашего топлива: дрова, торф, каменный уголь, нефть состоят из углеродистых соединений, и при горении весь их углерод превращается в углекислоту, которая вместе с остальными продуктами горения, поступает в атмосферу; 4) процессы дыхания и другие биологические процессы, совершающиеся не только в животных, но и в растительных организмах (см. дыхание и дыхание растений) и другие процессы. Наряду с этими процессами выделения углекислоты на земную поверхность в природе наблюдаются обратные процессы, удаляющие из атмосферы углекислоту и связывающие ее. Из таких процессов наиболее важными являются: 1) процессы, связанные с питанием и ростом растений (см. растение); 2) процессы, связанные с выветриванием массивных горных пород земной поверхности (см. выветривание, XI, 696/97). Совокупность процессов природы, поглощающих и выделяющих углекислоту обусловливает тот круговорот ее, при помощи которого поддерживается равновесие на земной поверхности и определяется неизменность содержания углекислоты в атмосферном воздухе.
Углекислота имеет большое значение не только в явлениях природы, но и в технике, и в повседневной жизни. В технике она требуется в различных производствах, например, сахарном, содовом (аммиачный способ) и др., кроме того, она применяется для газирования минеральных вод, для искусственного охлаждения (при помощи жидкой углекислоты) и пр. Получение углекислоты в больших количествах производится различными способами, важнейшими из которых являются следующие: во-1-х, пользуются углекислотой, выделяемой минеральными источниками, причем обыкновенно ее сгущают в жидкое состояние и в таком виде в срочных стальных баллонах (так называемых бомбах) выпускают в продажу. Подобный завод жидкой углекислоты имеется у нас в Кисловодске, и на нем сгущается в жидкость углекислота, извлекаемая из воды источника Нарзана; во-2-х, пользуются углекислотой, образующейся при горении топлива и заключающейся в продуктах горения (дымовых газах); в-3-х, пользуются углекислотой, получающейся при обжигании известняков для получения извести. При таком обжиге совершается реакция диссоциации углекислого кальция: СаСО3 = СаО + СО2.
Реакция эта идет нацело при температуре около 1 000°С. Иногда вместо известняка применяют доломит (СаСО3.MgCO2) и магнезит (МgСО3).
В лабораторной практике для получения углекислоты обыкновенно пользуются реакцией взаимодействия мрамора с какой-нибудь кислотой, лучше всего брать соляную кислоту. Реакция выражается следующим уравнением:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
Серная кислота менее удобна вследствие того, что образующийся сернокислый кальций малорастворим в воде.
Химические свойства углекислоты определяются, прежде всего, тем, что это есть окисел, образующийся путем непосредственного взаимодействия углерода и кислорода. Взаимодействие это носит характер горения, так как совершается с чрезвычайно большой скоростью и сопровождается выделением значительного количества теплоты (97 650 кал. на граммолекулу). Углекислота получается также при горении окиси углерода: 2СО + О2 = 2СО2, причем на каждую граммолекулу углекислоты в этом случае выделяется 68 220 калорий. Соединение окиси углерода с кислородом не идет до конца, но останавливается вследствие наступления химического равновесия между СО, О2 и СО2. Равновесие это обусловливается тем обстоятельством, что под влиянием нагревания углекислота разлагается на окись углерода и кислород: 2СО2 = 2СО + О2.
Это разложение под влиянием нагревания впервые было изучено Сен Клер Девиллем, который подобного рода реакции разложения назвал диссоциацией (см.). Таким образом углекислота в абсолютно чистом виде существовать не может и всегда находится в смеси с окисью углерода и кислородом, образуя систему такого состава:
(1 — х) СО2 + х СО + ½ х О2,
причем значение х зависит от давления и температуры. При атмосферном давлении х приобретает заметные значения только при очень высоких температурах — выше 1 000°, при обыкновенной же температуре х представляет ничтожно малую величину, которую практически можно считать равной нулю. Нижеследующая таблица, взятая из данных Лангмира (1906 г.), дает значения для х, выраженные в процентах по отношению к исходному объему углекислоты, т. е. показывает, сколько объемов углекислоты из 100 объемов ее находится в разложенном состоянии при температуре t°:
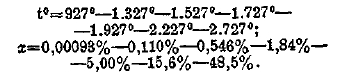
Как видно из этих данных, в заметных количествах диссоциация углекислоты начинает совершаться только около 1 600°. При уменьшении давления диссоциация усиливается, при увеличении давления — уменьшается. Изложенные данные о диссоциации углекислоты объясняют окислительные свойства этого вещества, которые обнаруживаются во многих случаях и тем значительней, чем выше температуры, как это и следует из понятия о диссоциации. Приведем несколько примеров: при обыкновенной температуре углекислота не оказывает заметного действия на водород, но при повышении температуры водород окисляется в воду согласно уравнению:
CO2 + H2 = H2O + CO
причем получается смесь всех четырех газов:
(1-x)CO2 + (1-x)H2 + xH2O + xCO
где значение х возрастает с повышением температуры. Подобным же образом выше 450° углекислота окисляет уголь и превращает его в окись углерода: C + CO2 = 2CO, причем также получается смесь газов:
(1—х) СО2 +2хСО
В этом уравнении при 450° величина х близка к нулю, при 1 100° — величина х близка к единице, т. е. при 1 100° углекислота в присутствии угля почти нацело переходит в окись углерода, — на этом основано действие генераторов (см. генераторный газ) — приборов, превращающих твердое топливо в газообразное. Окислительному действию углекислоты подвергаются и многие металлы (но не все); не говоря уже о таких металлах, как натрий, калий, магний, но даже железо при накаливании окисляется углекислотой, причем в зависимости от условий получается или закись железа или магнитная окись: Fe + CO2 = CO + FeO, 3FeO + CO2 = CO + Fe3O4. Медь углекислотой не окисляется ни при каких условиях. Все приведенные выше превращения являются процессами обратимыми, т. е. могут совершаться как в одном направлении (при нагревании), так и в обратном направлении (при охлаждении) и представляют случаи химического равновесия. Другая важная группа реакций углекислоты определяется тем, что углекислота, как окисел металлоида, есть ангидрид угольной кислоты. Сама угольная кислота H2CO3 неизвестна, но соли, ей отвечающие, известны очень хорошо, имеют большое значение, и многие из них встречаются в природе в виде минералов. Из солей угольной кислоты упомянем важнейшие: сода — Na2CO3, поташ — K2CO3, углекислый кальций — СаСО3, встречающийся в природе в виде мрамора, известняка и мела, железный шпат FeCO3, магнезит — MgCO3, витерит — ВаСО3, церуссит — РbСО3 и т.д. За исключением солей, образованных щелочными металлами, все углекислые соли характеризуются почти полной нерастворимостью в чистой воде, в присутствии свободной углекислоты растворимость их в воде увеличивается, иногда очень сильно, например, для углекислого кальция. Соли угольной кислоты образуются или при непосредственном взаимодействии гидратов окислов с углекислотой или при реакциях обменного разложения:
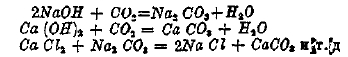
Реакция образования углекислого кальция из гидрата извести и углекислоты имеет важное значение в строительном деле, ибо она обусловливает твердение воздушных известковых растворов, причем углекислота для этого процесса берется из воздуха, поэтому без доступа атмосферного воздуха известковые растворы не отвердевают. Для характеристики солей угольной кислоты следует указать, во-1-х, что угольная кислота есть кислота двухосновная, т. е. содержит в своей частице два водорода, способные замещаться металлами, а поэтому, кроме средних солей, может давать кислые соли, например, NaHCO3, KHCO3, а во-2-х, что она есть кислота слабая, т. е. обнаруживает электролитическую диссоциацию в ничтожной степени, и потому анион ее СО3 в присутствии ионов водорода является неустойчивым и переходит в углекислоту:
![]()
Поэтому все углекислые соли при действии сильных кислот (HCl, H2SO4, HNO3) выделяют углекислоту:
MCO3 + 2HX = MX2 + H2O + CO2
обнаруживая характерное явление вскипания (выделение газообразной СО2). По той же причине растворимые средние соли угольной кислоты в водном растворе обнаруживают явления гидролитической диссоциации, т. е. имеют щелочную реакцию (действуют на лакмус, фенолфталеин и другие индикаторы). Наконец, этой же причиной определяется непрочность углекислых солей слабых оснований; нам, например, неизвестны углекислые соли окиси алюминия, окиси железа и т. п. Кроме средних и кислых солей известны также и основные как, например, малахит, CuCO2.Cu(OH)2, медная лазурь, 2CuCO3.Cu(OH)2. Большинство углекислых солей разлагаются при нагревания сравнительно невысоком. Сода и поташ на обыкновенных горелках плавятся без разложения.
А. Байков.
| Номер тома | 42 |
| Номер (-а) страницы | 34 |
