Железо
Железо (химический знак Fе, атомный вес 55,84). Железо, по Lepsius’у, было известно почти с незапамятных времен; египтяне, по его мнению, были знакомы с железом и его применением за 5000 лет до начала нашего летосчисления. Во всяком случае, более чем за две с половиной тысячи лет до Рождества Христова они знали железо и употребляли железные орудия, как об этом свидетельствуют: найденный в большой пирамиде Хеопса (2600 лет до Рождества Христова) кусок железа и часть серпа, найденная в Карнаке под сфинксом. Около 1475 г. до Рождества Христова употребление железа получило широкое распространение в Египте, что явствует из одной надписи времен фараона Thutmosis'а III. Египтянам были известны способы «закалки железа» Сталь была уже известна в Китае в царствование императора Yü (ІО), т. е. за 2220 лет до Рождества Христова. Изготовленная в царствование императора Ping-Wang’а чугунная башня пагоды свидетельствует о том, что за 750 лет до Рождества Христова китайцы были уже знакомы с чугунным литьем. Моисей упоминает о железе («Господь Бог твой поведет тебя в прекрасную страну... страну, камни которой — железо, чтобы ты вырубал руду (металл) из скал») и о печке для его получения; он считает, что человек «еще до потопа» был знаком с железом. Древние греки относили открытие железа ко временам Прометея. Арабскому алхимику Джафару (Dschabir, 750 лет по Рождеству Христову) был, по-видимому, известен железный купорос. Хлорное железо было впервые получено И. Глаубером в 1648 г. растворением железа в соляной кислоте и выпариванием полученного раствора. У алхимиков железо считалось посвященным богу войны Марсу и часто обозначалось его именем или значком планеты Марс ♂.
Железо вместе с никелем (Ni) и кобальтом (Со) образует группу, занимающую в периодической системе переходное положение между двумя октавами: кончающейся хромом и марганцем и начинающейся медью и цинком. Соответственно с этим положением, железо образует соли железной кислоты (ферраты) М’2FеО4 соли трехвалентного железа и соли двухвалентного железа, — соединения, отвечающие солям хромовой и марганцовистой кислот и солям окиси и закиси хрома и марганца. Никель представляет собой переход от железа и кобальта к меди и цинку. Чистое железо может быть получено посредством восстановления железной соли щавелевой кислоты в токе водорода или же, по способу Гольдсмита, восстановлением окиси железа порошком алюминия (cм. II, 394). Химически чистое железо — серебристо-белый, блестящий, мягкий металл, удельного веса 7,84, плавящийся выше 1000°. Полученное восстановлением своего хлористого соединения в токе водорода, железо выделяется в виде блестящих октаэдров; железо, полученное восстановлением окиси водородом при низкой температуре, представляет собой черный самовоспламеняющийся порошок (пирофорное железо); восстановление при высокой температуре дает железо в виде серого порошка, не обладающего пирофорными свойствами; осажденное гальваническим путем из аммиачного раствора железного купороса, железо является очень хрупким и обладает светло-серым цветом. Оно отличается более сильными магнитными свойствами, чем остальные металлы. Во влажном воздухе оно ржавеет, превращаясь в гидрат окиси железа. Относительно образования ржавчины не существует еще точных сведений. Часто высказывают предположение, что процесс ржавления обусловливается углекислотой воздуха: 2Fe + 2Н2СО3 = 2FeСO3+ 2H2; затем, под действием воды и кислорода, происходит гидролиз (разложение соли водой) углекислой соли и окисление: 2FeСО3 + 5Н2О + О = 2Fe(ОН)3 + 2Н2СО3; при этом выделяется то же самое количество угольной кислоты, которое затратилось раньше на образование FeCО3; выделившаяся кислота снова действует на металл, и, таким образом, для окисления больших количеств железа достаточно следов кислоты. Однако, Гейн и Бауэр утверждают, что железо ржавеет даже при тщательном удалении углекислоты. По другой теории, при лежании железа во влажном воздухе происходит одновременное окисление железо и воды: Fe + О2 + Н2О = FeО + Н2О2 и затем 2FeO + Н2О2 =Fe2О2(ОН)2. Присутствие перекиси водорода (как промежуточной стадии этого процесса) не удалось здесь доказать. Но при аналогичном ржавлении цинка легко показать, что она образуется. При ржавлении железо не получается сплошного слоя, защищающего металл от дальнейшего действия влажного воздуха, и ржавчина постепенно проникает в глубину, пока не проржавеет весь кусок. Чистое железо встречается в трех различных твердых аллотропических модификациях; модификацию, устойчивую ниже 780°, называют α-железо (феррит); оно отличается своими магнитными свойствами. Выше 780° эта форма переходит в немагнитное β-железо, а последнее при 910° переходит в γ-железо, также не обладающее магнитными свойствами. Железо горит в кислороде и при накаливании в атмосфере водяного пара отнимает кислород от частиц воды. Оно легко вытесняет водород из разбавленных кислот. Железо становится пассивным в концентрированной азотной кислоте, т. е. теряет способность вытеснять водород из кислот и другие более благородные, чем железо, металлы из их растворов. Пассивное состояние его легко уничтожить посредством механического раздражения какого-нибудь места его поверхности. Железо в своих солях двух и трехвалентно, образует, следовательно, как металл, два рода ионов: светло-зеленые ионы двухвалентного железа Fe” и почти бесцветные ионы трехвалентного железа Fe’” . Входя в состав железной кислоты (известны ее соли), железо играет роль металлоида и является шестивалентным, образуя сложный ион
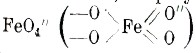
При действии на раствор соли трехвалентного железа раствором основания получается гидроокись железа (гидрат окиси): FeCl3 + 3NaOH = Fe(OН)3 + 3NaCl, в виде бурого хлопьевидного аморфного осадка, постепенно теряющего воду и переходящего при этом в окись железа: 2Fe(OН)3 — ЗН2O = Fe2O3, — буровато-красный порошок в высушенном состоянии; при осторожном нагревании последней в струе водорода, она теряет часть кислорода, переходя в закись железа: Fe2O3 + Н2 = Н2O + 2FeО, окисел двухвалентного железа, черного цвета. Гидрат закиси железа получается при действии растворов оснований на растворы солей двухвалентного железа: FeSO4 + 2NaOH = Fe(OН)2 + Na2SO4, в виде белого осадка, который быстро окисляется на воздухе в гидрат окиси железа. Соли двухвалентного железа также легко переходят (окисляются) в соли трехвалентного. Если пропускать хлор через калийный щелок (KOH), в котором суспендирован гидрат окиси железа, то образуется красный раствор калиевой соли железной кислоты K2FeO4. Здесь образующаяся в растворе при действии хлора калиевая соль хлорноватистой кислоты окисляет гидрат окиси железа в железную кислоту (железо из трехвалентного становится шестивалентным): 2Fe(ОН)3 + ЗН2O + ЗKОCl = ЗKCl + 2Fe(OН)6; Fe(OН)6 — 2Н2O = FeO2(OН)2.
Соответствующего этой кислоте ангидрида неизвестно, но существование солей его гидрата (т. е. солей железной кислоты) указывает на то, что в кислородных соединениях железо, по мере увеличения относительного содержания кислорода в частице, металлический (основной) характер окисла переходит в металлоидный (кислотный); это подтверждается еще и тем, что гидрат окиси является более слабым основанием, чем гидрат закиси. При действии перекиси водорода на соединения железа удалось изолировать вещество, обладающее характерными свойствами настоящей перекиси, — соли перекиси водорода, — т. е. выделяющее перекись водорода при действии разбавленных кислот. Вещество это светло-красного цвета, менее коллоидального вида, чем гидрат окиси железа, и очень непостоянно. Его вероятный состав FeO2 и строение
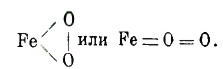
При действии раствора цианистого калия на растворы солей двух и трехвалентного железа получаются осадки цианистых соединений железа: FeCl2 + 2KCN = Fe(CN)2 + 2КCl и FeCl3 + 3KCN = Fe(CN)3 + ЗКCl. Оба эти осадка растворяются при дальнейшем прибавлении раствора цианистого калия: Fe(CN)2 + 4KCN = К4Fe(CN)6 (желтая кровяная соль, железисто-синеродистый калий) и Fe(CN)3 + 3KCN = К3Fe(CN)6 (красная кровяная соль, железно-синеродистый калий); эти соединения — калиевые соли кислот железистосинеродистоводородной Н4Fe(CN)6 и железосинеродистовородной H3Fe(CN)6; железо в этих солях входит в состав комплексных анионов Fe(CN)6'''' и Fe(CN)6'''.
Аналитические реакции ионов железа и важнейшие его соединения. Ион двухвалентного железа — светло-зеленый, ион трехвалентного — почти бесцветный; желтая окраска солей трехвалентного иона зависит от гидролиза (см. гидролиз и теория электролитической диссоциации) их: Fe''' + 3(Н'ОН') = Fe(ОН)3 + ЗН', причем выделяющийся гидрат окиси остается в растворе в коллоидальном состоянии (см. коллоиды, и коллоидальное состояние материи). Сернистый аммоний осаждает из солей двухвалентного и трехвалентного железа сернистое железо, растворимое в разбавленных кислотах с выделением сероводорода. Растворимые соли угольной кислоты осаждают из солей трехвалентного железа гидрат окиси. С калиевой солью железистосинеродистоводородной кислоты соли двухвалентного железа дают белый, соли трехвалентного железа — синий осадок Fe4[Fe(CN)6]3 — берлинскую лазурь, окисножелезную соль железистосинеродистоводородной кислоты. К3Fe(CN)6 образует с солями трехвалентного железа бурый раствор, с солями же двухвалентного железа — темно-синий осадок Fe3[Fe(CN)6]2—турнбуллеву синь, закисно-железную соль железосинеродистоводородной кислоты. Роданистый калий KCNS дает в растворах солей трехвалентного железа кровяно-красное окрашивание, вследствие образования родановаго железа Fe(CNS)3. Натриевая соль уксусной кислоты образует в избытке соли трехвалентного железа красную, слабо распадающуюся на ионы, но сильно гидролизованную железную соль уксусной кислоты. При кипячении гидролиз раствора усиливается, и, наконец, осаждается нерастворимая основная железная соль уксусной кислоты Fe(OH)2.С2Н3O2. Кроме указанных выше соединений железа заслуживают упоминания еще следующие. Железный купорос, или сернокислая соль двухвалентного железа, PeSO4 7Н2O— зеленые кристаллы; сернокислая соль трехвалентного железо Fe2(SO4)3, образующая с сернокислыми солями щелочных металлов кристаллы двойной соли, железные квасцы, например К2SO4.Fe2(SO4)3.24Н2O. Хлорное железо FeCl3.6Н2O (получающееся из хлористого FeCl2 действием хлора) — красно-бурые пластинки. При кипячении его раствора с железом оно превращается в хлористое, кристаллизующееся в бледно-зеленых кристаллах. Калиевая соль железной кислоты К2FeO4 — темно-красные призматические растворимые в воде кристаллы. Азотистое железо Fe2N(?) — серовато-белая масса, обладающая магнитными свойствами. Пентакарбонил железа Fe(СO)5 (соединение железа с окисью углерода) — янтарно-желтая жидкость, переходящая на свету в золотистые кристаллы гептакарбонила Fe(СО)7. Силикат железа, т. е. железная соль кремневой кислоты, является составной частью многих минералов.
О железных рудах и железе в техническом отношении см. приложение.
Л. Писаржевский.
1. Железо и железные руды.
Из тяжелых металлов самую большую распространенность в земной коре имеет железо; его содержание оценивается в 4,5%. Железо входит в состав весьма многих минералов различного происхождения. Оно имеется в земной коре в виде самородного металла, в виде разнообразных сернистых и кислородных минералов. Если богатые содержанием железа минералы, не содержащие вредных примесей, скопляются в значительном количестве, они образуют залежи железной руды. Каждому хорошо известно, какую исключительную роль играет в настоящее время железо. Теперешнюю нашу жизнь — наш «железный век» — было бы даже трудно представить себе без железа. Ввиду этого поиски железных руд, их разведка, добыча ведутся уже с очень давних нор. Принимая во внимание то, что рассматриваемое полезное ископаемое требуется в большом и все возрастающем количестве (по справедливости, культурность или, вернее, зажиточность каждой страны оценивается по количеству пудов ежегодно потребляемого железа, приходящегося на каждого человека), неудивительно, что довольно значительные участки земли раскрыты благодаря подобным разработкам. Ряд общих минералогических вопросов нашел свое более полное и подробное освещение при изучении минералов — железных руд, т. е. полезного ископаемого, являющегося предметом постоянной заботы человека. Остановимся на некоторых минералах, богатых содержанием железа (часть из них служит важнейшими железными рудами), находящихся в тесном генетическом соотношении между собой.
Самородное железо. В течение долгого времени сомневались в существовании земного (телурического) самородного железа. В настоящее время это точно установлено. Крупные скопления самородного железа найдены были в 1870 г. Норденшильдом в Овифаке, на южном берегу острова Диско, в западной Гренландии. Первоначально это железо было принято за космическое (метеоритное), но вскоре обнаружилось, что оно представляет собой теллурическое железо, приуроченное к определенной изверженной породе — базальту. Самородное железо залегает в базальте в виде блесток, зерен и иногда мощных глыб. В России самородное железо было найдено в анамезите (разновидность базальта) в Волынской губернии, к северу от г. Ровно, близ деревни Берестовец и селения Златцы (А. Карпинский). Химический состав самородного железа — сложен; обыкновенно присутствуют Ni, Со, Сu, С, S и др. Особенно важно отметить содержание никеля, так как в прежнее время полагали, что присутствие или отсутствие его может решить вопрос о космическом или теллурическом происхождении самородного железа. Теперь установлено, что никель содержится в земном железе, и даже известны (Новая Зеландия) особенные разности самородного железа — авариус, весьма богатый никелем (до 67,6%). Возможность получения нидманштедтовых фигур (см. метеориты) на самородном земном железе оспаривается некоторыми авторами (В. Вернадский). Другой, весьма редкий, тип самородного железа представляют месторождения этого минерала как вторичного продукта: самородное железо образовалось путем восстановления кислородных соединений железа.
Из сернистых соединений железа наибольшую распространенность имеет железный колчедан (серный колчедан, пирит) — FeS2. Желая оттенить его распространенность, старые немецкие авторы несколько пренебрежительно отзывались о нем, говоря, что это — Hans in allen Gassen. Такого же состава FeS2 имеется и другой минерал — марказит. Этим минералам чаще всего придают такие формулы: пирит
![]()
И марказит
![]()
В железном колчедане присутствуют Cu, Mn, Co, Ni, As и др. В марказите As (мышьяк) имеется обычно даже в большем количестве, чем в пирите. В марказите из Олькуши, Келецкой губернии, содержащем 5% As, встречен Тl (таллий) — 0,31%. Пирит кристаллизуется в правильной системе (3λ2.4λ3.с 3π или, вернее, 3λ3.4λ3) и часто встречается в форме превосходно образованных многогранников роста — кубов, пентагональных додекаэдров, октаэдров и их комбинаций (рис. 1) и др.
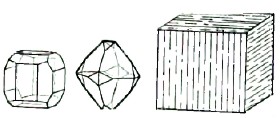
Рис.1. Рис. 2
Весьма характерна комбинационная штриховатость, идущая параллельно ребрам куба (рис. 2), причем на каждой паре соседних граней направления штриховатости взаимно перпендикулярны, в соответствии с присутствием 4λ3. Кюри обнаружил в высокой степени интересную зависимость между термоэлектрическими свойствами железного колчедана и направлением штриховатости граней кристаллов. Железный колчедан встречается также в виде плотных масс, зернистых, шаровых, почковидных и т. д.; непрозрачен, обладает металлическим блеском, светло-желтый с несколько сероватым оттенком, иногда буроватая побежалость. Твердость — около 6. При ударе молотком по железному колчедану получается сноп искр (пирит). Марказит кристаллизуется в ромбический снег. Многогранники роста имеют таблицевидный облик. Весьма часты двойники, простые и полисинтетические (копьевидный колчедан). Встречается в форме почковидных, гроздевидных, шаровых, натечных и сталактитовых масс с шестоватой, волокнистой или плотной структурой.
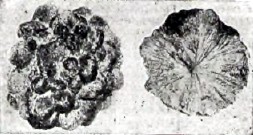
Рис. 3
На рис. 3 — конкреция марказита с поверхности и в разрезе. Нередко имеются самые тесные срастания железного колчедана и марказита (как результат перехода одной разности в другую). Удельный вес железного колчедана (4,9—5,2) больше, чем марказита (4,5—4,8). Месторождения железного колчедана (и марказита — в дальнейшем они рассматриваются вместе) — весьма разнообразны и многочисленны. Железный колчедан встречается, как несущественная составная часть, в различных изверженных породах, как основных, так и кислых. Весьма большим распространением пользуются железные колчеданы в жильных месторождениях. Можно сказать, что почти не имеется металлоносных жил, которые не содержали бы железный колчедан. В качестве примера можно привести жилу железного колчедана, около сажени толщиной, проходящую в тальковых сланцах в Соймоновской долине, Кыштымского округа, на Урале. Железный колчедан встречается в кристаллических сланцах и гнейсах, причем он иногда бывает рассеян в них в виде пылинок и мелких зерен (фальбанды). Порой включения железного колчедана увеличиваемся в своих размерах, получаются более крупные образования — линзы железного колчедана. В качестве примера месторождений подобного типа можно указать ряд месторождений в различных областях Норвегии, содержащих, кроме железного колчедана магнитный колчедан (главным образом Fe11S12) медный колчедан, CuFeS2, реже свинцовый блеск PbS, цинковую обманку, ZnS и друг. Месторождения представляют собой линзы, расположенные согласно с окружающими их сланцами и обыкновенно достаточно резко отграниченных от последних. Объяснение происхождения этих месторождений вызывает еще существенные разногласия. Железный колчедан встречается в различных осадочных породах. Отлично образованные кубические кристаллы его — нередки в глинистых сланцах (рис. 4 — фот. подобного образца Лакруа).

Рис.4
В этих случаях, надо думать, во время роста кристалла шло раздвигание окружающей массы, т. е. приготовление кристаллом необходимой для его роста полости. Насколько сложны протекающие здесь процессы, можно судить по тому, что в ряде месторождений превосходные кристаллы железного колчедана, находящиеся в глинистых сланцах, заключены еще в оболочку другого, постороннего минерала, например, в силикатовую оболочку (α-хлоритит)-кристаллы в Нагольном кряже, в оболочку кварца — в окрестностях ст. Казбек и др. (Я. Самойлов). Железный колчедан встречается в различных глинах, мергелях, известняках и т. д. в виде желваков и конкреций. Он находится в торфе, буром угле, каменном угле, как нежеланный спутник последнего, понижающий достоинство угля. В этих случаях железный колчедан выделяется из соответственных растворенных солей железа путем их восстановления, в котором весьма важную роль играют органические вещества. По этому поводу можно вспомнить некоторые указания, которые в характерном, несколько старинном, изложении приводятся в превосходной книге Брейтгаупта, посвященной общим вопросам парагенезиса. Химик Тоннам, по словам Брейтгаупта, долго не убирал своей лаборатории. Когда, по прошествии нескольких лет, он стал приводить ее в порядок, то в одним большом стакане, содержавшем раствор железного купороса, он нашел мышь, совершенно превратившуюся в железный колчедан — получился псевдоморфоз железного колчедана по мыши. В XVIII столетии в большой шахте в Фалуни (Швеция) по несчастной случайности провалился в глубокий колодезь рабочий. Только спустя 50 лет доработали этот рудник до того места, куда проникло тело рудокопа, и оно было извлечено, совершенно превращенное в железный колчедан. На этом минералогическом превращении был построен даже ряд литературных произведений, в которых, однако, по словам Брейтгаупта, было допущено много поэтических вольностей. Это превращенное в железный колчедан тело рудокопа (псевдоморфоз по телу человека) хранилось в течение нескольких лет в фалунском музее (еще теперь об этом трактует соответственная надпись в музее), после чего оно уже окончательно распалось вследствие обратного превращения железного колчедана в железный купорос. Эти, своеобразно изложенные, химические уравнения обычно протекают в земной коре, и подобным образом в ряде случаев идет образование железного колчедана.
Среди современных отложений дна морского (Колла) видную роль играют отложения голубого ила, содержащие водное сернистое железо. Интересны отложения Черного моря, как известно, изобилующего сероводородом. Извлекаемый со дна этого моря ил представляет две разности: черный ил и темно-голубой.
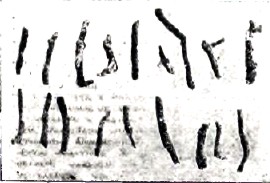
Рис.5
Окраска ила зависит от присутствия водного односернистого железа. Последнее в более глубоких сдоях, ила обнаруживает постепенный переход в FeS2 (диагенезис). Мелкие конкреции железного колчедана обнаружены в драгировочном материале Черного моря. Фотография подобных желваков, часто гвоздеобразной формы, любезно переданных автору И. И. Андрусовым, представлена в естественную величину на рис. 5.
Довольно устойчивый в определенных условиях минерал, железный колчедан под влиянием действия воды и кислорода претерпевает превращение (еще легче подвергается превращению марказит). Высказывается взгляд (Жюльен), что способность железного колчедана к превращению находится в теснейшей и прямой зависимости от содержания в нем марказита. Железный колчедан с содержанием последнего около 10% еще весьма устойчив. Способность к разложению железного колчедана различного типа месторождений — неодинакова; так, железный колчедан, залегающий в различных глинах, особенно тонко рассеянный, выветривается очень легко в то время, как более плотные кристаллические массы его, залегающие, например, в сланцах, труднее поддаются разрушению. Превращение железного колчедана идет в сторону его окисления Схематически реакция протекает: FeS2 + Н2O + 7O = FeSO4 + H2SO4 получаются сульфаты железа и серная кислота. Подобный процесс иногда даже с большой быстротой, идет на образчиках железного колчедана и наших минералогических коллекциях, оставляя наглядные красноватые пятна разъедания кислотой на этих клетках. Железный колчедан испытывает дальнейшее окисление и переходит в более устойчивые окисные соединения железа. Только в редких случаях этот процесс разложения железного колчедана сопровождается выделением самородной серы — таков генезис некоторых месторождений последнего минерала.
Наиболее обычно превращение железного колчедана и самые устойчивые в поверхностной зоне минеральные тела, как бурый железняк (2Fe2O3.3H2O). В зависимости от условий, в каких протекают подобные реакции, получается определенная ассоциация минералов (парагенезис): 4FeS2 + 15O2 + 3H2O + 8CaCO3 = 2FeO3.3H2O + SCaSO4 + 8CO2. Наглядно все это уравнение читается иногда на отдельных минеральных образцах, в которых внутреннюю часть образца представляет первичное минеральное тело — железный колчедан в поверхностных частях превращенный уже в бурый железняк; рядом с ним залегает гипс, нередко в виде отлично образованных кристаллов. Порой превращение железного колчедана в гидраты окиси железа идет с полным сохранением формы первоначального минерала — получаются превосходно выраженные псевдоморфозы бурого железняка по железному колчедану, на которых даже остается еще отчетливая тонкая штриховатость железного колчедана. Этот процесс, наблюдаемый на отдельных образцах, протекает и в крупных размерах, обусловливая образование целых залежей бурых железняков за счет указанного превращения железного колчедана. Месторождения железного колчедана весьма часто бывают с поверхности покрыты залежью бурого железняка с другими вторичными минералами (образовавшимися за счет превращения спутников железного колчедана); это — т. н. железная шапка (Eiserner Hut, chapeau de fer). Несмотря на высокое содержание железа, рассматриваемый минерал не представляет собой железной руды вследствие большого содержания серы. Железный колчедан является рудой для изготовления серной кислоты. Железными рудами служат описываемые ниже различные кислородные соединения железа.
Среди последних значительной распространенностью пользуется сидерит (шпатовый железняк) — углекислая закись железа, FeCO3. Обычно в составе сидерита имеется Мn, Mg, Са, обязанные присутствию изоморфных примесей карбонатов марганца, магния, кальция. Кристаллизуется в гексагональной системе и обычно встречается в форме основного ромбоэдра, который нередко бывает седлообразно искривлен. Другие формы, кроме основного ромбоэдра, очень редки. Совершенная спайность по плоскостям основного ромбоэдра. Твердость 3,5—4,5. Удельный вес 3,7—3,9. Цвет — серый, желтовато-серый, желтовато-бурый. Иногда образует полушаровые агрегаты — сферосидерит. Встречается зернистый, плотный сидерит. Когда к нему примешивается значительное количество глины, он называется глинистым сидеритом. Если последний образует шаровые конкреции — глинистый сферосидерит. Один из важных типов месторождений сидерита — жильный тип. Известны многочисленные сидеритовые жилы, тело которым состоит из рассматриваемого минерала; к нему примешиваются кварц или кальцит, и в подчиненном количестве присутствуют различные сернистые минералы. Еще большее значение имеют метасоматические месторождения сидерита, обязанные превращению известняков в сидерит. Из них самое замечательное месторождение — Эрнберг, к югу от г. Эйзенерца, в Штирии. Здесь имеются весьма мощные залежи сидерита, толщина которых в среднем достигает 60 метров, а в отдельных пунктах доходит до 125 м. В некоторых участках можно наблюдать переход от чистого сидерита к анкериту CaCO3.(Mg, Fe, Mn)CO3, и от последнего, через ряд промежуточных ступеней, — к известняку. Разработка руды ведется здесь в очень широких размерах и с очень давнего времени; уже у римлян это месторождение пользовалось большой славой. В России подобные месторождения сидерита имеются в различных областях средней России, Царства Польского, на Урале (Ельничный рудник, ср. ниже). В зоне выветривания сидерит сравнительно быстро и легко испытывает превращения (окисление и гидратацию) и переходит в водную окись железа (ср. ниже); обычны — подобные псевдоморфозы.
Одну из важнейших железных руд представляет магнетит (магнитный железняк), Fe3O4. Он рассматривается как соль кислоты
![]()
, в которой выделяется частица воды: О — Fe — ОН; две такие группы
![]()
или FeFe2O4. Магнетит является представителем целого семейства изоморфных минералов — шпинелевой группы, в которой 3-х атомное железо отчасти или целиком заменяется Аl, Сr.Мn, Тi, а 2-х атомное железо — Mg, Mn, Zn. Магнетит, как и вся шпинелевая группа, кристаллизуется в правильной системе и нередко наблюдается в превосходно выраженных многогранниках роста, чаще всего — в октаэдрах. На рис. 6 представлена фотография октаэдров магнетита в слюдяном сланце. Магнетит встречается в виде плотных и зернистых масс.

Рис.6
Одним из замечательных свойств магнетита является присущий ему в высокой степени природный магнетизм. На некоторых кусках магнетита можно наблюдать и полярный магнетизм. Магнетит встречается обычно в различных изверженных породах, как одно из первых минеральных выделений при затвердевании расплавленной магмы. Он присутствует в виде мелких зерен, кристалликов, превосходно образованных дендритовых форм (рис. 7 представляет фотографию шлифа базальта с подобными дендритовыми формами, магнетит увеличен в 30 раз). Обычно он находится рассеянным в незначительном количестве. Но иногда среди изверженных пород встречаются в большом количестве массы магнетита, представляющие весьма ценные залежи железной руды.

Рис.7
К самым богатым и замечательным месторождениям магнетита принадлежат лапландские месторождения Швеции — области Кируны и Гелливары, представленные преимущественно магнетитом (Гейер). Руда содержит относительно много апатита (см.), следовательно, богата содержанием фосфора. Известные уже давно залежи здешних руд приобрели исключительное значение после того, как выработана была техника переработки руд, богатых содержанием фосфора. В настоящее время в этой дикой, пустынной местности идет чрезвычайно энергичная добыча полезного ископаемого.

Рис.8.
На рис. 8 представлен один из холмов, состоящих из магнетита. Залежи магнетита приурочены здесь к сиенитам, сиенитовым порфирам, кварцевым порфирам и т. д., с которыми магнетит находится в самом тесном соотношении. Генезис этих месторождений вызывает еще много споров. Большинство исследователей рассматривает эти залежи, как результат дифференциации расплавленной магмы (при участии пневматолитических процессов). Лапландские залежи магнетита сопоставляются с известными уральскими месторождениями этого полезного ископаемого — гора Благодать, Высокая. Гора Благодать расположена на восточном склоне Урала, в Пермской губернии, близ Кушвинского завода (верстах в 120 к северу от г. Екатеринбурга). Она поднимается над окружающей слабоволнистой местностью метров па 160 в виде пологой возвышенности, вытянутой в северо-восточном направлении (к юго-западу от Благодати в 8 верстах находится другая небольшая возвышенность — Малая Благодать, также содержащая магнетит). Гора имеет две вершины, из которых южная, более высокая, украшена часовенкой и памятником в честь вогула Чумпика, по преданию, указавшего благодасткое месторождение магнетита. От этой вершины протянулся ряд террасообразных разработок в разнос. Разработка горы Благодать началась с 30-х годов ХVIІІ стол. Магнетит приурочен к ортофирам с вкрапленниками полевых шпатов и авгита. Эти ортофиры образуют всевозможные переходы к грубозернистым авгитовым и уралитовым сиенитам, а равно к плотным ортоклазовым породам, сходным с соответственными лапландскими породами.
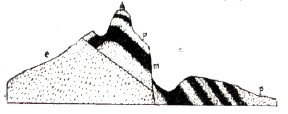
Рис.9
В лежачем боку эти порфировые породы, заключающие магнетит, обогащаются эпидотом, гранатом и др. и переходят в эпидотогранатовую породу. Руда залегает или в виде пластообразных жил различной мощности, или в виде значительных гнезд и штоков. На рис. 9 (р — ортоклазовый порфир, m — магнетит, с — эпидотогранатовая порода) изображен разрез Гороблагодатского месторождения (Ф. Чернышев). К западу от Нижне-Тагильского завода находится гора Высокая, имеющая в длину около 2 км и в ширину около 1 ½ км и поднимающаяся над уровнем заводского пруда на 80 м. Магнетит залегает несколькими пластообразными толщами, чередующимися с изверженными сиенитовыми и гранатовыми породами. Кроме пластообразных толщ, магнетит встречается в виде глыб и штоков неправильной формы. Месторождение обнаруживает сложную систему сдвигов и сбросов. Наряду с гипотезами о происхождении этих месторождений магнетита путем магматической дифференциации высказываются и другие взгляды (профессор Левинсон-Лессинг, Яковлев). Гора Магнитная представляет группу гор, занимающую площадь около 26 кв. км, близ реки Урала, в Верхнеуральском уезде. Из этой группы особенно выделяются четыре горы: Атан, Березовая, Дальняя и Узянка. Главная масса возвышенности сложена из разнообразных изверженных пород: авгитовые и амфиболовые граниты, авгитовые диориты, сиениты, диабазы и др. На авгитово-полешпатовых породах, обыкновенно выветрелых, залегает гранатовая порода, состоящая из кальциево-железистого граната (меланита) с небольшим количеством альмандина и сиессартина (зерна и кристаллы граната сцементированы кварцем). Гранатовая порода считается вторичной по отношению к авгитово-сиенитовым и диоритовым. Руда не залегает в непосредственном соприкосновении со свежими изверженными породами, а повсюду между последними и рудой имеется пояс гранатовой породы, часто также разрушенной или эпидотизированной. Руда сложена главным образом из магнетита отчасти из мартита (т. н. псевдоморфозы красного железняка по магнетиту) и из красного железняка, иногда бурого железняка. Этому месторождению приписывается гидрохимическое образование (И. Морозевич). Первоначальные авгитово-полевошпатовые породы изменились в гранатовую породу, а последняя путем выветривания — в эпидотово-гранатовую с отделением руд (производится расчет, согласно которому при превращении граната может получиться около 30% свободных окислов железа) Против этой гипотезы высказываются некоторые возражения.
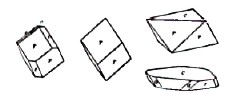
Рис.10
Значительной распространенностью в земной коре пользуется безводная окись железа — Fe2О3 — гематит (красный железняк, железный блеск). Кристаллизуется в гексагональной системе (кл. — λ3.3L2c3P) и нередко встречается в виде превосходно образованных многогранников роста. На рис. 10 представлены некоторые многогранники роста гематита: г|1011|, е |0112|, a|1120|, е |0001|. На рис. 11 изображена фотография гематита с выступающими кристаллами.

Рис.11
Различные условия образования до известной степени сказываются на характере многогранников гематита. Так, один из способов образования гематита приурочен к взаимодействию между парообразными продуктами, выделяющимися в известную стадию вулканической деятельности. Среди различных других летучих веществ очень нередко идет выделение паров Fe2Cl6, которые вступают в реакцию с парами воды: Fe2CI6 + ЗН2O = Fe2O3 + 6HCl; образующийся гематит обычно выделяется в форме типичных таблицевидных многогранников. Такие же таблицевидные формы гематита получаются и при искусственном воспроизведении этой реакции в сходных условиях (Арцируни). Иногда (особенно в месторождениях С.-Готарда) гематит встречается в виде красивых образований, носящих название железных роз (рис. 12); в таких образцах обычно обнаруживают присутствие титана. Гораздо чаще гематит встречается не в ясно образованных кристаллах, а в виде плотных зернистых волокнистых масс.

Рис.12
Попадаются образования с характерным сложением – одновременно концентрически-скорлуповатым и радиально-волокннстым, т. н. красная стеклянная голова (рис. 13).

Рис.13
Цвет черты гематита — вишнево-красный. Удельный вес — от 4,9 до 5,3; твердость 0—6. Весьма важный тип месторождений гематита представляют месторождения, приуроченные к кристаллическим сланцам. В различных сланцах и гнейсах наблюдаются чешуйки, зернышки, небольшие линзы гематита. Количество гематита может возрастать (железистые сланцы), при дальнейшем сгруживании вся порода превращается в рудное тело, или обособляются слои, линзы гематита, иногда весьма значительных размеров. К этому типу принадлежит известное Кривирожское месторождение, находящееся на границе Херсонской и Екатеринославской губернии, близ впадения реки Саксагани в реку Ингулец (приток Днепра). Рудные месторождения приурочены к метаморфическим сланцам, которые выступают в виде обособленной, вытянутой почти в меридиональном направлении километров на 50 полосы, не превышающей в поперечном направлении 6—7 км. На гнейсы налегают здесь согласно более молодые сланцы и образуют весьма сложную и запутанную систему складок. (На отдельных небольших образцах можно нередко видеть чрезвычайно отчетливую тонкую и прихотливо изогнутую складчатость; рис. 14 представляет уменьшенный в 2 ½ раза образчик с чередующимися слоями гематита и железистого кварцита).

Рис.14
Верхний отдел сланцев состоит из железисто-кварцитовых сланцев (сложенных из кварца и окислов железа), которым подчинен целый ряд других сланцев — хлоритовый, тальковый и др. — и гематит. Содержание железа в железисто-кварцитовых сланцах подвергается значительным колебаниям в одном и том же слое гематит включен в виде больших линзообразных зон, которые к краям беднеют и замещаются пустой породой. Отложениям этим приписывают очень древний возраст — докембрийский. Месторождения рассматриваются, как осадочные; предполагается отложение, отчасти последовательное, отчасти одновременное, механических осадков (кварц) и химических (водные окислы железа, позднее преобразованные в гематит и частью магнетит). Отложения эти впоследствии подвергались сложным тектоническим нарушениям. Высокого качества криворожский гематит дал начало обширнейшей железоделательной промышленности на юге России, чему в высокой степени содействовала близость Донецкого каменноугольного бассейна, доставляющего богатые запасы ископаемого горючего материала. Другой тип месторождения гематита представляют контактовые месторождения. Сюда принадлежат, например, месторождения острова Эльбы, выработка которых началась еще в очень отдаленное время — уже этруски работали здесь нд добыванием железной руды. В последние годы разработка ведется здесь в больших размерах. Залежи приурочены к восточной части острова, в полосе, протянувшейся с севера на юг километров на 15. Древнейшими отложениями этой отчасти являются гнейсообразные сланцы многократно пересеченные жилами гранита и прикрывающиеся слюдяными сланцами. На последние - sc (рис. 15) — налагаются известняки с, которые самым неправильным образом переходят в породу р, богатую различными, содержащими воду, известково-железистыми силикатами — пироксен-ильвант-гранатовую породу, заключающую в себе железную руду f, представленную гематитом, а также магнетитом и отчасти бурым железняком (продукт превращения). К ним примешан железный колчедан, отчасти медный, и другие сернистые минералы. Некоторые выработки близ Rio-Marina издавна прославлены превосходными кристаллами гематита и железного колчедана.
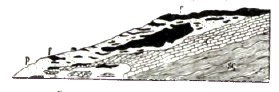
Рис.15
Хотя непосредственного соприкосновения с гранитами в рудном поле здесь невозможно проследить, однако вся совокупность данных говорит за то, что месторождения эти контактометасоматические; что они связаны с глубинными кислыми породами. Гематит встречается также в жилах. Этот тип месторождений гематита не имеет серьезного практического значения. Чаще всего жилы гематита приурочены к массивам изверженных пород. Иногда подобные жилы гематита образуются фумарольным путем, из парообразных продуктов. Брейтгаунт описывает, что в 1817 г., во время одного из извержений Везувия, открылась трещина больше, чем в 3 фута толщиной; в течение 10 дней трещина заполнилась гематитом, выделившимся из паров Fe2CI6. Это наблюдение интересно также и тем, что здесь зарегистрирована продолжительность времени, какое потребовалось на образование месторождения. В различных местностях среди осадочных пород имеются залежи гематита, рассматриваемые, как метасоматические месторождения. Принимается, что первоначально имелась залежь известняков, которые перешли в водные окислы железа, а эти последние превратились в безводную окись железа — гематит. Ниже этот процесс будет рассмотрен несколько подробнее.
Гидраты окиси железа. В этой группе различается ряд минеральных тел:
Турвит – 2Fe2O3.H2O (содержание воды – 5,3%)
Гетит – Fe2O3.H2O (10,1%)
Гидрогетит – 3Fe2O3.4H2O (13,1)
Лимонит – 2Fe2O3.3H2O (14,5)
Ксантосидерит – Fe2O3.2H2O (18,4)
Из всех этих минералов в окристаллизованном виде известен только гетит и гидрогетит (см.). Все остальные минералы этой группы не окристаллизованы. Они — аморфны. Вода в этих минералах имеет такой характер, как в гидрогелях (см. VII, 332 и коллоиды). Эти минералы рассматриваются как гидрогели окиси железа. Не все они обнаруживают одинаковую устойчивость; не все обладают одинаковой распространенностью. Наиболее частый минерал этой группы — лимонит (бурый железняк), по сравнению с которым все остальные встречаются гораздо реже; однако некоторые, например, турвит, по-видимому, пользуются большей распространенностью, чем это обыкновенно принимают. Анализ обнаруживает в этих минералах присутствие АІ, Мn, Р, S, органических соединений, кремнезема и др., отчасти в виде изоморфных примесей, отчасти как результат тесно связанных механических примесей. Наружный вид минералов этой группы — весьма разнообразен. Они встречаются в виде плотных зернистых и землистых масс. Иногда встречаются волокнистые разности, а также радиально - лучистые и одновременно концентрически-скорлуповатые (бурая стеклянная голова), сталактитовые формы (рис. 16) и т. д.

Рис.16
Иногда лимонит залегает в глинистой породе в виде желваков самой замысловатой формы; встречается оолитовый лимонит, состоящий из отдельных сцементированных шаровых зерен (оолитовая боровая руда) и г. д. Цвет черты — буровато-желтый, различных оттенков. Удельный вес 3,5—3,9. Твердость 5.
Один из довольно обычных путей образования водных окислов железа связан с разрушением и превращением более сложных железосодержащих минералов — силикатов. В этих последних железо содержится или в виде окиси, как аналог глинозема и окиси хрома — в так называемых ферросиликатах, или в виде закиси железа, как аналог магния, кальция и т. д.
Вообще, как уже упоминалось выше, железо находится в земной коре в виде закисных и окисных соединений; но эти соединения обладают неодинаковой устойчивостью в поверхностной зоне коры. Закисные соединения представляют подвижные, лабильные соединения; они могут переходить в раствор, между тем как окисные соединения - стабильны, неподвижны. Наиболее обычны реакции, представляющие переход закисных соединений в окисные; в этом направлении идет превращение минералов на земной поверхности. Подвижное закисное соединение железа при превращении в окисное захватывается и прикрепляется. Обратные процессы восстановления окисных соединений железа — несравненно более исключительны и редки. Процесс окисления и восстановления железа имеет место и в животных организмах — в крови животных (гемоглобин, гематин). При процессе разрушения, выветривания различных силикатов водная окись железа выделяется обыкновенно в виде бурого железняка; но в некоторых случаях имеет место образование и других минералов этой группы. Так, например, в характерных почвах тропического и субтропического пояса — латеритах, водная окись железа имеется в виде турвита, чем объясняют и характерный кирпичный цвет этих почв. Точно так же водные окислы железа получаются в результате превращения, выветривания железосодержащих сернистых соединений. Об этом процессе приходились уже говорить выше, при описании тех изменений, какие испытывает железный колчедан в поверхностной зоне земной коры.
Значительное распространение и важное практическое значение имеют залежи водных окислов железа, приуроченные и генетически связанные с известняками — метасоматические месторождения (замещения первоначальной породы водными окислами железа). Воды, циркулирующие в известняках, несут в растворе углекислое железо. Последнее менее растворимо, нежели СаСО2 и MgCО3. Происходит замещение — карбонаты кальция и магния замещаются карбонатами железа. Залежи известняка могут таким образом переходить в залежи шпатового железняка — FеСО3. Иногда наблюдаются месторождения в этой стадии процесса (ср. выше); обычнее — дальнейшая стадия окисления и переход в водные окислы железа. Эти переходы нередко иллюстрируются превосходно образованными псевдоморфозами; так, известны отчетливые псевдоморфозы лимонита по кристаллам кальцита, шпатового железняка. Подобный процесс идет порой в очень крупном масштабе — получаются обширные и мощные залежи водных окислов железа — ценной железной руды. Само собой разумеется, что для подобного скопления железа руды требуется приток весьма большого количества железа. Месторождений подобного типа довольно много. Одним из богатейших подобных месторождений является Бакальское месторождение в южном Урале, в Златоустовском горном округе, верстах в 20 от Саткинского завода. Вдоль параллельных кряжей Иркускана, Шунды и Буландихи тянется ряд обширных разработок и, разнос (открытых) — рудники Бакальский, Успенский. Тяжелый, Ельничный, Ивановский и др., в которых добыча началась уже с очень давнего времени и производится теперь в крупных размерах, доставляя руду весьма высокого качества (рис. 17 представляет фотографию Тяжелого рудника).

Рис.17
Руда — бурый железняк и турвит — залегает в девонских отложениях, подстилается глинистыми сланцами (лежачий бок) и прикрывается кварцитами (висячий бок). Принимается, что водные окислы железа заместили здесь известняки. Необходимый для этого запас железа мог быть получен при превращении, которое претерпели имеющиеся вблизи залежей железных руд изверженные породы (диабазы), также железо могло доставляться восходящими источниками, связанными с проникновением диабазов в верхние горизонты, что находит некоторое основание и в парагенезисе обнаруженных среди руд минералов (гидротермальный тип). В некоторых рудниках Бакальского месторождения, кроме водных окислов железа, в значительном количестве встречается и шпатовый железняк (особенно Ельничный рудник). Здесь можно отчетливо видеть поучительную картину смены шпатовых железняков бурыми, а в некоторых пунктах и переход известняков в шпатовый железняк. Издавна известны также месторождения железных руд центральной России, выработка которых началась еще в первой половине XVII столетия и ведется и по сию пору, то увеличиваясь в своих размерах, то ослабевая. Железные руды залегают в губерниях Тульской, Калужской, Тамбовской и др. Они приурочены к палеозойским известнякам, с которыми они связаны генетически. В некоторых рудниках эго замещение известняков углекислым железом и дальнейшее превращение в водную окись железа видно довольно явственно. В известных случаях подобные метасоматические месторождения водной окиси железа могут испытывать процесс дегидратации — получаются залежи безводной окиси железа — гематита (ср. выше).
Можно только отметить, что иногда такое толкование генезиса железа месторождений применяется слишком распространительно. В качестве примера можно указать залежи гематита на Гарце, которые рассматривались как метасоматические; однако при более детальном исследовании месторождения обнаружены некоторые данные, не согласующиеся с приведенной гипотезой.

Рис.18
Укрываются образцы гематита, содержащие известковые раковины, не обнаруживающие никакого превращения и даже с поверхности нисколько не измененные. На рис. 18 видны совершенно свежие известковые трубки Aulopora serpens в гематите; на рис. 19 еще более резкая картина; в гематите рассеяны членики морских лилий, внутренний топкий канал которых заполнен гематитом, между тем как самые членики, состоящие из СаСО3, нисколько не изменены (Гарборт).

Рис. 19
Подобные факты не могли бы иметь места, если бы действительно происходил метасоматический процесс — процесс превращения известняков в водную и затем безводную окись железа. Высказывается мысль, что это месторождение гематита - первичное, что гематит отлагался одновременно с известняками. Здесь шло выделение паров хлорного железа, происходившее не на поверхности земли, а на дне моря; этому фумарольному процессу и обязаны своим происхождением залежи гематита. Одновременно шло и отложение морских осадков. Таким образом, здесь одновременно протекали два различных процесса. Особенно интересны наблюдения над самым процессом выделения водных окислов железа из растворов на земной поверхности. Здесь образование минерального тела в очень многих случаях самым тесным образом связано с флорой (и изредка даже с фауной) той среды, из какой идет образование минерала.
Отложения водных окислов железа (может быть, первоначально более сложных органических соединений железа) вызываются деятельностью различных организмов. Имеются особенные бактерии, которые носят название железобактерий (С. Виноградский, Молиш, Потонье). Они захватывают находящиеся в растворе соединения закиси железа (подвижные) и переводят их в нерастворимые, окисные.

Рис.20
На рис. 20, в сильно увеличенном виде, представлена подобная нитчатая железо-бактерия — Chlamydothrix ochracea. Как известно, в различных водах, лужах, болотцах можно наблюдать ржаво-бурые пленки, которые при микроскопическом исследовании весьма часто обнаруживают массу железо-бактерий.

Рис.21
На рис. 21 представлен препарат железной охры из слаботекучей воды, на котором видны многочисленные Chlamydothrix ochracea и продукты их жизнедеятельности. Согласно С. Виноградскому, плазма этих бактерий обладает специфической способностью окисления соединений закиси железа; путем такого окисления эти бактерии приобретают необходимую для жизни энергию (получается род минерального дыхания). Благодаря участию организмов в этих процессах, последние могут протекать в среде, содержащей очень незначительное количество железа. В рассматриваемом вопросе весьма поучительны некоторые случайные наблюдения. В качестве примера можно привести подробно описанные наблюдения над дрезденским водопроводом (Шорлерь). Построенный в этом городе водопровод стал обнаруживать серьезные недочеты. При исследовании причин (спустя 30 лет после постройки) обнаружилось, что заложенные железные водопроводные трубы, имевшие просвет в 10 см, покрылись изнутри коркой водных окислов железа толщиною в 3 см, а местами еще более толстой, почти закрывавшей просвет. Образование этой корки нисколько не было связано с заржавлением самых труб, которые, напротив, не претерпели за это время никаких изменений. Эти корки водных окислов железа образовались за счет жизнедеятельности бактерий - Leptothrix ochracea, которые были обнаружены в ржавых пленках самой внутренней части корки. Подобные факты весьма ценны с минералогической точки зрения. В воде дрезденского водопровода содержалось ничтожное количество железа - всего 0,2—0,3 мг на литр воды: и такого количества оказалось достаточно для образования довольно толстых корок лимонита. В этом случае также получили точные указания, сколько времени потребовалось для скопления определенных количеств рассматриваемого минерала. Наконец, согласно произведенному исследованию, обнаружено, что в самой массе железа корки (вне указанной выше внутренней пленки) никаких следов бактерий не имеется. В корке произошла внутренняя перегруппировка, получилась новая структура, уничтожившая какие бы то ни было остатки работавших над созданием руды организмов. Это наблюдение весьма важно для оценки значения отрицательных результатов, получающихся часто при поисках остатков бактерий в уже давно сформировавшихся отложениях водных окислов железа. Можно еще отметить, что подобные железные корки обнаружены в водопроводных сетях ряда других городов. Это — настоящие заболевания водопроводных труб, представляющие иногда довольно серьезное бедствие.
Над выделением водных окислов железа работают и водоросли (некоторые представители Oedogonium, Cladophora и др.). Некоторые диатомовые содержат в своем панцире, кроме кремнезема, окись железа. Ряд лишайников способен откладывать окислы железа (formae oxydatae). Они поселяются на различных горных породах, содержащих железо. Чем порода богаче железом, тем чище проявляются на ней лишайники (formae oxydatае), что хорошо известно флористам. Получается до некоторой степени анализ породы в отношении железа при помощи лишайников. Способностью захватывать закисные соединения железа и отлагать их в виде окисных обладают также и некоторые животные.
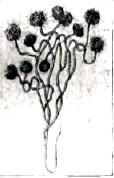
Рис.22
На рис. 22 представлена колония Antophysa vegetaus, принадлежащая к группе Flagellatae, (жгутиковые), из первичных животных (Protozoa). Колония имеет общий стебель, в котором (в более старых частях) идет откладывание водной окиси железа. Несомненно, отложения водной окиси железа могут идти и идут в ряде случаев без какого-либо участия организмов. Однако деятельность последних в создании подобных отложений, можно думать, имеет совершенно исключительную важность.
Из наиболее молодых или продолжающих еще на наших глазах отлагаться скоплений железа руды можно назвать болотные руды, дерновые, луговые и др., чаще всего образующиеся путем химико-биологической реакции. Сюда же должны быть отнесены и озерные руды. Они приурочены к определенным глубинным горизонтам (не глубже 10 м), именно к тем, которые представляют наиболее благоприятные условия для процветания растительных организмов. Обычно озерная руда встречается в форме мелких шаровидных желваков или характерных плоских дисков (денежная руда). Озерные руды имеются на севере Европейской России, в Финляндии, Швеции, в северной Германии и др. Добыча их производится особенными черпаками со дна озера. В течение 15—30 лет накопляется уже новый слои озерной руды толщиной в 10—15 см, пригодный для следующего багрения. Можно еще упомянуть о своеобразных отложениях на дне Финского залива в береговой зоне на небольшой глубине (3—7 саженей). Здесь залегают характерные плоские желваки (рис. 23), внутри которых имеется галька какого-либо постороннего тела — гранита, известняка и т. д., облеченная концентрически-скорлуповатыми пленками бурого железняка, содержащего марганец. В заключение можно привести еще следующее. Исходя из той исключительной важности, какую представляют железные руды, исполнительный Комитет XI Международного Геологического Конгресса, заседавшего в 1910 г. в Стокгольме, поставил вопрос об исчислении мировых запасов железной руды. В этой коллективной работе приняли участие более 50 геологов различных стран. В результате получилось капитальное сочинение: «The Iron Ore resources of the World», дающее возможность ориентироваться в поставленном вопросе. Запасы железной руды разделены на действительные (actual) и предполагаемые (potential) ввиду весьма неодинаковой полноты и детальности, с какой исследованы различные участки земной коры. Конечно, в отдельных случаях отнесение залежей к одной или другой группе несколько субъективно. Так как в исчисляемых запасах фигурируют руды с различным процентным содержанием железа (от 30% до 50% и больше), то ниже приводятся запасы, перечисленные на металлическое железо, содержащееся в них.

Рис.23
По отдельным частям света запасы в миллионах тон таковы (действительный запас; предполагаемый запас) в млн. тонн:
Европа – 4733; 12085;
Америка – 5154; 40731;
Австралия – 74; 37;
Азия – 156; 283;
Африка – 75; -;
Всего – 10092; более 53136.
По отдельном государствам Европы действительные запасы железа в миллионах тонн выражаются следующими числами: Германия — 1270, Франция — 1140, Швеция — 740, Великобритания — 455, Европейская Россия — 387,2, Испания — 349, Норвегия — 124, Австрия — 90,4, Люксембург — 90, Греция — 45, Бельгия — 25, Венгрия — 13,1, Италия – 3,3, Швейцария — 0,8. Для того, чтобы получить более конкретное представление о приведенных выше числах, можно привести еще следующие указания. Мировая добыча железа возрастает весьма быстрым темпом. Рост добычи чугуна в течение XIX столетия иллюстрируется следующими числами в миллионах тонн:
1800 г. – 0,8
1850 г. – 4,8
1871 г. – 12,9
1891 г. – 26,2
1901 г. – 41,2
1909 г. – 60.
Таким образом, в течение каждых последних двух двадцатилетий производство чугуна больше чем удваивается. Если принять такой темп расширения производства чугуна и в дальнейшем, то имеющихся действительных запасов железной руды хватит только на 60 лет. Конечно, подобное число имеет только относительное значение, так как в разряд действительных перейдут при дальнейшей геологической работе крупные предполагаемые запасы: далее, могут обнаружиться и совсем еще неизвестные залежи руды; наконец, позднейшие усовершенствования в технике металлургии железа могут перевести в разряд железных руд и такие минеральные тела, какие при современном состоянии техники рудами не считаются. Однако и при относительном значении указанных чисел они представляют несомненный интерес.
Литература. Некоторые из работ, авторы которых упоминались выше. А. Карпинский, «Научно-исторический сборник» (изд. Горн. Инст., 1873, стр. 21); В. Вернадский, «Опыт описательной минералогии» (1908. I, 162): J. Curie, «Bull. d. I. Soc. mineral. d. l. France» (1885. VIII, 128); Я. Симонов, «Материалы для геол. России» (1906. XXIII, 126); А. Breithaupt, «Die Paragenesis dor Mineralien» (1849, 21 и 124): А. Lacroix, «Mineralоgie. d. l. France» (1896. II, 572); L. Collet, «Lеs depots marins» (1908, 40); Н. Анорусов, «Извест. Русск. Геогр. Общ.» (1892, стр. 395); А. Julien, «Annals of the Nеw-York Acad. ol Science» (1987, III, 365 и IV, 125); G. Gеjеr, «Geology of the Kiruna district» (1910); А. Arаruni, «Vergleich. Bеobachtung. an künstllen. u, natürlich. Mineralen», Zeitschr. f. Kryst. (1891. XVIII, 4-1); R. Harbort, «Zur Frage nach dor Entstehung gewiss. devonisch. Rotheisonerzlagerst». Keues Jahrb. f. Miner. (1903. 1, 179); H. Potonie, «Eisenerze veranlasst durch die Tätigkeit von Organismen» Naturw. Wochenschr. (1906. XXI, 161); S. Winogradsky, «Ueber Eisenbakterien». Botan Zeit. (1888, .№ 17, 261); В. Schorler, «Die Rostbildung in den Wasserleitungen». С ntralbl. f. Bakteriolog. 1906 (II Abtb.), XV. 561; Н. Мolisch, «Die Eiscnbakterien» (1910); Н. Мolisch, «Die Pflanze u. ihre Beziehungen zum Eisen» (1692); The Iron Ore resources of the World (an inquiry made upon the initiative ot Execut. Committ е of the XI Intern. Geol. Congr.) (1910). Обстоятельные очерки различных месторождений железных руд имеются в общих руководствах (там же приводятся и списки литературы): R. Beck, «Lebre von d. Erzlagerstatten» (1909): А. Stelaner u. А. Burgent, «Die Erzlagerstatten» (1904—6), F. Beyschlag, Р. Krusch u. J. Vogt, «Die Lagerstatten der nutzbaren Minevalien u. Gesteine» (1910—1912): L. De-Lannay, «Gites mineraux et metalliteres» (1913. I-III); К. И. Богданович, «Рудные месторождения» (1912) и др. Полный очерк геологического характера месторождений железных руд России, их распространения и запасов имеется в работе К. Богдановича, «Железные руды России» (1911). В этой монографии приводится подробный список литературы, трактующей о русских месторождениях железных руд.
Я. Самойлов.
2. Железо с технической стороны.
Химически чистого железа в продаже не существует; элементы, которые всегда сопровождают железо и образуют с ним сплавы, суть: углерод, кремний, марганец, сера, фосфор, алюминий, кальций, титан, вольфрам, хром и др. Соединяясь с не металлами, железо образует наиболее важные для техники сплавы: чугун, сталь и собственно железо (нечистое, продажное). Эти сплавы различаются своими физическими свойствами, которые главным образом зависят от содержания в сплаве углерода. Сплав железа с содержанием углерода более 2% называется чугуном; его свойства см. чугун. По мере того, как содержание углерода уменьшается, чугун переходит в сталь и затем в железо. При пудлинговом процессе производства стали и железа довольно резко отличались друг от друга; в настоящее же время, когда готовятся литые железные сплавы (см. ниже железоделательное производство, стб. 37-43). невозможно провести резкой границы между сталью и железом, так как по мере убывания углерода один продукт постепенно переходит в другой. Чем больше углерода в железе, тем оно становится, тверже и крепче (до известного предела), но зато понижается точка плавления, уменьшается вязкость, ковкость и способность свариваться. Когда содержание углерода становится более 0,5%, — железо приобретает свойство закаливаться, что является характерным признаком стали. При содержании углерода 1,75% сталь теряет способность свариваться. При содержании углерода 1,8% сталь трудно куется, а при 1,9% ковать ее совершенно невозможно: нагретая докрасна сталь разлетается на куски под ударами молота. Химический состав некоторых сортов железа и стали приведен в таблице.
|
|
|
Fe |
C |
Si |
Mn |
P |
S |
|
Хорошее шведское сварочное железо |
Древесный уголь |
99,733 |
0,075 |
0,114 |
Следы |
0,004 |
0,012 |
|
Шведское железо литое |
Westanfors |
99,866 |
0,085 |
0,008 |
Следы |
0,025 |
Следы |
|
Сварочное железо йоркширское |
Low-Moor |
99,372 |
0,016 |
0,122 |
0,280 |
0,106 |
0,104 |
|
Сварочное железо йоркширское (Bowling) |
Замечательно чистое |
99,798 |
0,272 |
0,000 |
0,000 |
0,000 |
Следы |
|
Литое железо Barrow in Furness |
Для проволоки |
99,334 |
0,200 |
0,179 |
0,214 |
0,026 |
0,030 |
|
Литое железо (Neuborg) |
Для паровых котлов |
99,567 |
0,250 |
0,016 |
0,136 |
- |
0,010 |
|
Сталь бессемеровская |
Для рельсов |
99,095 |
0,352 |
0,053 |
0,384 |
0,061 |
0,065 |
|
Сталь Сименса и Мартена |
- |
99,173 |
0,370 |
0,040 |
0,342 |
0,033 |
0,042 |
|
Твердая инструментальная сталь (тигельная) |
- |
98,586 |
1,144 |
0,166 |
0,104 |
- |
- |
Приведенная таблица представляет химический состав особенно хороших сортов стали и железа, каковые вырабатываются только немногими железоделательными заводами Европы и Америки.
Вообще железо хороших сортов содержит от 0,05% до 0,25% углерода. Чем меньше в нем таких примесей, как кремний, сера и фосфор, тем больше железа может содержать углерода, не проявляя способности закаливаться.
Сопротивление железа и стало разрывающим усилиям колеблется в весьма больших пределах. Приведенная ниже таблица дает коэффициенты крепости и вязкости, характеризующейся удлинением образца до разрыва, для различных сортов железа и стали, расположенных в таблице с постепенно возрастающим содержанием углерода.
Коэффициент крепости тигельной стали достигает 160 кг. Разрывающее усилие относится к первоначальному сечению бруска. Удлинение определяется в % первоначальной длины бруска, равной 200 мм. Как оказывается, коэффициент крепости, взятый отдельно, не вполне характеризует способность металла сопротивляться разрыву. Некоторые сорта железа и стали обладают очень большим коэффициентом крепости, но вместе с тем при растяжении дают очень малые удлинения и сжатия поперечного сечения, что указывает на их малую вязкость, а также и на их твердость. Такие сорта железа, обладающие малой вязкостью, могут оказывать большое сопротивление спокойным нагрузкам, но вместе с тем легко разрушаются под действием ударов.
Ввиду этого для характеристики материала дают совместно с коэффициентом крепости величину удлинения и сжатия поперечного сечения в месте разрыва. Гораздо удобнее для оценки качества железа и стали определят их живое сопротивление, т. е. работу, которую нужно употребить для разрыва образца. При этом для того, чтобы сравнение было возможно, нужно, чтобы размеры сравниваемых образцов были одинаковы, или же — чтобы работа была приведена к единице объема образца.
Крепость и вязкость железа может изменяться под влиянием некоторых факторов: при нагревании крепость сначала немного увеличивается по мере возрастания температуры до 300°С, а затем начинает уменьшаться; вязкость же увеличивается. При низких же температурах вязкость значительно уменьшается и железо становится хрупким. Очень опасна, при обработке железа, температура от 200° до 300°С (синий нагрев); обработанное при таких температурах железо становится очень хрупким. Чтобы восстановить его первоначальные свойства, необходимо железо отжечь, т. е. нагреть до высоких температур и медленно охладить. Очень вредное влияние на крепость железа оказывают примеси фосфора и серы. Фосфор, хотя и повышает коэффициент крепости, но еще более сильно понижает вязкость и живое сопротивление; примесь фосфора не должна превышать 0,1%. Сера увеличивает твердость железа, сообщает ему красноломкость и уменьшает способность свариваться, поэтому железо, содержащее серу, совершенно не годится для обработки в горячем состоянии. Примесь серы в котельном железе не должна превышать 0,08%: в железе для других целей, в присутствии марганца, содержание серы может подняться до 0 2%. Содержание кремния менее 0,15% почти не оказывает влияния; большее же содержание повышает предел упругости и крепость, но заметно уменьшается вязкость. Содержание 0,35% делает железо холодноломким и красноломким. Вредное влияние кремния значительно ослабляется марганцем, так что в его присутствии железо с содержанием кремния до 0,5% может хорошо обрабатываться в горячем состоянии.
Если на твердую сталь капнуть хотя слабым раствором серной или соляной кислоты, то в этом месте она почернеет. Происходит это от растворения железа и отложении тонкого слоя углерода. Чем больше содержание углерода, тем сильнее будет действие кислоты. Этим свойством стали пользуются для приготовления так называемых дамасских клинков (см. дамаскирование, XVII, 540-41).
Железо способно окисляться, или ржаветь. Особенно сильно ржавеет железо при совместном действии кислорода, углекислоты и сырости. Если не принимать меры, то железное изделие может быть ржавчиной совершенно разрушено. Самым простым средством от ржавчины может служить окраска, которую, конечно нужно время от времени возобновлять. Хорошая краска должна прочно приставать к поверхности металла; не должна разъедать металл; быть достаточно твердой, чтобы сопротивляться истиранию, и в то же время быть настолько упругой, чтобы не давать трещин и не откалываться при деформациях металла. Краска должна быть непроницаема для сырости и не подвергаться сама действию сырости и других элементов, действующих на металл. Наилучшей краской является окись-перекись свинца (сурик). Металлические окислы представляют собой пигмент, который удерживается на поверхности металла при помощи льняного масла. Краски из окиси цинка совершенно непригодны для окраски металла, так как они очень легко отстают от его поверхности.
|
|
Марки |
Разрывающее усилие, кг на кв. мм |
Удлинение в % |
Назначение металла |
|
Сварочное железо |
В |
До 30 |
До 8 |
Сортовое железо |
|
ВВ |
31-36 |
15-10 |
Универсальное и сортовое железо |
|
|
ВВВ |
34-39 |
25-15 |
- |
|
|
Литое железо |
ММММ |
30-35 |
38-30 |
Сваривающие листы, универсальное железо и пр. |
|
МММ |
34-41 |
30-20 |
Листы и разные фасонные профили |
|
|
ММ |
41-46 |
25-18 |
- |
|
|
М |
46-50 |
20-15 |
Разные профили, балки |
|
|
Сталь |
№1 |
50-55 |
20-15 |
Валы, балки |
|
№2 |
55-59 |
20-15 |
Основа вагонов и паровозов, рельсы |
|
|
№2 ½ |
59-65 |
18-2 |
Бандажи, рельсы |
|
|
№3 |
65-70 |
12-5 |
Бандажи, рельсы и рельсы конной ж.д. |
|
|
№3 ½ |
70-80 |
16-10 |
Рельсы конной ж.д., разные пружины |
|
|
№4 |
80-90 |
8-2 ½ |
Спиральные пружины, рельсы конной ж.д., резаки |
|
|
№5 |
Свыше 90 |
6-1 |
Пружины по специальному требованию |
Асфальтовые краски, а также краски из окиси железа непрочны и непригодны для предохранения железа, хотя они и часто применяются. С той же целью поверхность железа покрывается тонким слоем других металлов, менее подвергающихся разъеданию. Тонкий слой наносится или при помощи гальванопластики или друг, способ. Наиболее часто для этой цели употребляется цинк (и получается цинкованное железо) или олово; покрытое им тонкое железо носит название жести. Если железный сплав содержит примесь других металлов, то получаются так называемые специальные стали (вольфрамовая, никелевая, хромовая, кремнистая и др.), обладающие весьма интересными свойствами. О внутреннем строении железа см. металлография.
А. Гавриленко.
| Номер тома | 20 |
| Номер (-а) страницы | 143 |
