Углеводороды
Углеводороды, простейшие органические соединения. В состав их входят только углерод (С) и водород (Н). Отсюда — их название. Все углеводороды — нейтральные вещества, нерастворимые в воде; в органических растворителях (эфир, спирт и т. п.) они более или менее хорошо растворяются. Углеводороды разделяются на несколько рядов, каждый из которых обнимает группу гомологов и изомеров, отличающихся друг от друга лишь величиной молекулы в строением. Между собой ряды углеводородов различаются как по составу, так и по свойствам. Различие в составе заключается в различных отношениях между числом атомов углерода и водорода, входящих в состав углеводородной молекулы. По теории строения цепь из n углеродных атомов может присоединить к себе, самое большее, 2n+2 атомов водорода. Величина 2n+2 может быть названа таким образом предельной емкостью насыщения цепи из n углеродных атомов. Углеводороды общей формулы CnH2n+2 называются поэтому предельными, или насыщенными. Далее следуют углеводороды ненасыщенные, или непредельные по составу. Мы имеем здесь несколько рядов углеводородов, состав которых выражается формулами CnH2n, CnH2n-2, CnH2n-4, CnH2n-6 и т. д. Каждый из них имеет характерные особенности в свойствах, а следовательно, и в строении и поэтому должен быть рассмотрен отдельно.
Предельные углеводороды. Ряд CnH2n+2 (парафины). Это наиболее обширный ряд углеводородов. Число известных относящихся сюда гомологов измеряется десятками. Кроме того, начиная с бутана, С4Н10, для каждого гомолога известно по нескольку изомеров, например, бутанов — 2, пентанов — 3, гексанов — 5 в т. д. Для высших гомологов теория строения предвидит еще большее число изомеров, быстро возрастающее с увеличением веса молекулы. Простейшие представители этого ряда: СН4 — метан, С2Н6 — этан, С3Н8 — пропан и С4Н10 — оба бутана — газообразные вещества; далее следуют жидкие углеводороды: С5Н12 — пентаны, С6Н14 — гексаны и т. д.; начиная же с С16Н34, гексадекана (температура плавления 18°) — твердые. Наиболее сложный углеводород этого ряда, полученный искусственным путем, — С60Н122, гексаконтан. В виде сложной смеси многие из этих углеводородов встречаются в нефти, особенно американской; твердые — также в горном воске (озокерит). В чистом виде их можно получить лишь искусственным путем, по одному из следующих методов: 1. Действие водорода в момент выделения на галоидопроизводные, например, C2H5J + 2H = C2H6 + HJ. 2. Действие металлического натрия на такие же производные, например, 2C2H6J + 2Na = C4H10 + 2NaJ. Существуют и другие способы получения предельных углеводородов, причем простейшие из них могут быть синтезированы прямо из элементов; сравни, например, метан. Характерная особенность этих углеводородов — исключительная устойчивость к различным реагентам. Отсюда их наименование — парафины (parum affinis). Все они совершенно неспособны к реакциям присоединения («предельный характер»). Реакции же замещения протекают здесь лишь при наличности особых условий, как-то солнечный свет, повышенная температура и т. п. Так, например, галоидоводородные кислоты вовсе не реагируют с парафинами; хлор на рассеянном свету действует медленно; на прямом же солнечном — энергично, с обугливанием, (ср. метан), к серной и азотной кислотам углеводороды этого ряда при обыкновенной температуре вполне устойчивы; при повышенной же температуре и определенной концентрации образуются титросоединения и сульфокислоты, например, C6H14 + HNO3 = C5H13NO2 + H2O. О техническом применении парафинов см. нефть, озокерит, парафин.
Непредельные углеводороды. Ряд CnH2n. Среди углеводородов состава CnH2n резко обособляются две группы. Одна из лих, нафтены, по своим химическим свойствам чрезвычайно близко напоминает парафины; другая, олифины, характеризуется склонностью к реакциям присоединения («непредельный характер»).
Нафтены. Вместе с парафинами нафтены образуют главную массу нефти (особенно кавказской); отсюда их название. Характерная особенность их — предельный характер при непредельном составе — обусловливается особой структурой из молекулы: все они имеют замкнутое или циклическое строение. Сопоставим, например, формулы нормального пептана, С4Н12, и одного из пентанафетнов, C5H10, - циклопептана или пентаметилена:
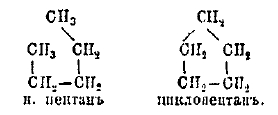
Нетрудно видеть, что в обоих этих углеводородах все валентности насыщены, а потому и химические свойства обоих углеводородов должны быть примерно одинаковы. По характеру цикла нафтены могут быть довольно разнообразны. Наиболее изучены углеводороды с три-, тетра-, пепта-, гекса- и гептаметиленовыми циклами, их гомологи и производные. Наименование их слагается обыкновенно из соответствующего обозначения представители парафинового ряда с прибавлением приставки цикло. Таковы, например:
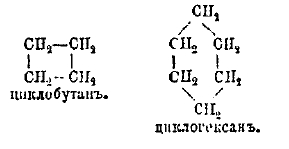
Основная задача получения нафтенов и их производных сводится к замыканию соответствующего цикла. В некоторых случаях это достигается действием металлического натрия на дибромид, например:
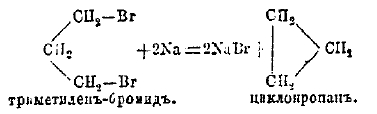
В других случаях к той же цели можно подойти, например, сухой перегонкой двухосновной кислоты:
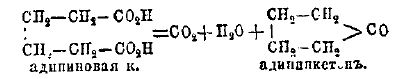
Получающийся при этом циклический кетон может быть превращен обычными реакциями последовательно в алкоголь, галоидопроизводное и, наконец, в углеводороды — цпклопентан. Наконец, как особый способ получения циклогексана и его производных, следует упомянуть действие водорода в присутствии катализаторов (Ni, Pt) на ароматические соединения (бензол и др.), а также и вообще гидрогенизацию углеводородов и соединений непредельного характера, уже содержащих ту или иную замкнутую систему.
По своей устойчивости к различным реагентам нафтены с различными циклами значительно отличаются друг от друга. Так, например, циклопептан и циклогексан вполне устойчивы к галоидоводородным кислотам и к брому; на циклопропан же бром не реагирует только в темноте, а йодистоводородная кислота уже при обыкновенной температуре превращает этот углеводороды и нормальный иодистый пропил с распадом цикла: C3H6 + HJ = C3H7J. Такое различие в устойчивости различных циклов обусловливается главным образом причинами стереохимнческого характера.
Олефины. По имени простейшего представителя, этилена, С2Н4, углеводороды этого ряда называются также этиленовыми. Их характерное отличие от нафтенов и парафинов — необычайная склонность к реакциям присоединения. Они легко соединяются с галоидоводородными кислотами и галоидами, например: С2Н4 + Сl2 = С2H4Cl2, (см. масло голландских химиков); в присутствии катализаторов (Ni, Pt) они присоединяют два атома водорода, переходя в соответствующие парафины; легко реагируют с различными окислителями, причем и здесь в первую очередь образуются продукты присоединения. Таково, например, образование озонидов (см. перекиси органические). В других случаях подобного рода первоначальные фазы реакции неуловимы, и обнаруживаются лишь продукты дальнейшего окисления. Таковы, например, гликоли (см.), получающиеся при действии на этиленовые углеводороды хамелеона при охлаждении: C2H4 + O + H2O = C2H4(OH)2 (этиленгликоль). Всю совокупность подобных химических свойств обыкновенно обозначают, как «ненасыщенный, или непредельный характер», который должен обусловливаться, конечно, какой-то особенностью в структуре соответствующих соединений. Обыкновенно в них допускают наличность так называемой двойной связи, по месту которой и происходят все вышеозначенные реакции; существуют однако и другие воззрения на их строение. Олефины получаются отщеплением воды от спиртов или галоидоводородных кислот от галоидопроизводных, например: СН3СН2ОН—Н2О → СН2=СН2. (этилен). Они образуются также при сухой перегонке разнообразных органических веществ и встречаются поэтому в некоторых технических продуктах (светильный газ).
Ряд CnH2n-2. В этом ряду, так же как и в предшествующем, встречаются углеводороды двоякого рода: углеводороды с открытой цепью (I) и углеводороды циклические (II). I. В ряду CnH2n-2 с открытой цепью непредельный характер выражен еще более резко, чем у олефинов. Все они легко поддаются действию окислителей. К водороду, галоидам и галоидоводородным кислотам относятся так же, как олефины, с одним лишь отличием: здесь могут присоединяться уже 4 атома водорода или галоида и соответственно 2 молекулы галоидоводородной кислоты. Известно 2 класса углеводородного ряда CnH2n-2 с открытой цепью:
1. Ацетиленовое углеводороды. Сюда относится простейший представитель этого класса, С2Н2 —ацетилен (см.) и его гомологи (см. аллилен). Все реакции присоединения протекают здесь по месту двух соседних атомов углерода. Теория строения допускает поэтому между ними особую краткую связь (тройную), как это видно, например, из формулы ацетилена СНΞСН. Конечно, и здесь, так же как в формуле олефинов, кратная связь является лишь символом для обозначения определенной совокупности химических свойств. Характерная особенность ацетилена — способность образовать металл, производные, которые при действии воды или разбавленных кислот дают обратно ацетилен. Таково, например, взрывчатое серебряное соединение, C2Ag2, получаемое при пропускании ацетилена в аммиачный раствор азотно-кислого серебра. Некоторые из подобных соединений готовятся технически (см. карбиды). Подобно метану и этилену, ацетилен также входит в состав светильного газа.
2. Диолефины. Ко второму классу углеводородов ряда CnH2n-2 с открытой цепью относятся несколько групп углеводородов, у которых в реакции присоединения 4 одновалентных атома (водорода, галоида) принимают участие больше, чем 2 соседних атома углерода. Во всех таких углеводородах допускают поэтому наличность двух двойных связей. Отсюда их общее название. Таков, например, аллен, СН2:С:СН2, и его гомологи; бутадиен, СН2:СН.СН:СН2, и др. Некоторые из этих углеводородов представляют большой интерес, теоретический и практический; таков, например, изопрен, СН2:С(СН3).СН:СН2 (метил-бутадиен), легко получаемый из лимонена (см.).
II. Циклические углеводороды ряда CnH2n-2 могут быть как непредельного — нафтилены (1), так и предельного характера — бициклические углеводороды (2).
1. Нафтилены. По способам получения к химическим свойствам, а, следовательно, и структуре нафтилены так же относятся к нафтенам, как олефины к парафинам. Следовательно, это непредельные циклические углеводороды с одной двойной связью. Таков, например, циклогексен, легко получаемый отщеплением воды от циклогексанола:
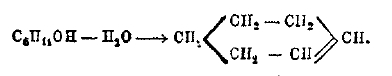
2. Бициклические углеводороды предельного характера имеют ближайшее отношение к некоторым важнейшим природным соединениям. Таков, например, камфен, С10Н18, углеводороды, соответствующий камфаре (см,). Лучший способ их получения — каталитическое разложение соответствующих гидразонов (Кижпер):
![]()
Структура их вытекает из строения веществ, служащих исходным продуктом для их получения.
Ряд CnH2n-4. Важнейшие представители этого ряда имеют состав С10Н16. Это — так называемые терпены, широко распространенные в растительном царстве. Для получения их измельченные части растений подвергают обработке водяным паром. В отгоне получают смесь терпенов и их производных, которые разделяют затем фракционировкой и другими методами. Среди терпенов имеются углеводороды с открытой цепью и тремя двойными связями, например, мирцен (см.); циклические (2 двойных связи), например, лимонен (см.); и, наконец, бициклические, с одной двойной связью, как-то: пинен (см.), камфен (см.) и др. Все они обладают резко выраженным непредельным характером; легко окисляются даже кислородом воздуха и различными способами превращаются в ароматические углеводороды и их производные (ряд CnH2n-6).
Ряд CnH2n-6. Важнейший класс углеводородов этого ряда принадлежит к так называемым ароматическим соединениям (см.). Сюда относятся: С6Н6 — бензол (см.), СН3.С6Н6 - толуол (см.), С6Н4(СН3)2 — ксилолы (см.) и т. д. Несмотря на большое удаление от предела, ароматические углеводороды почти неспособны к реакциям присоединения. Лишь водород в присутствии катализаторов (Ni, Pt) при строго определенной температуре присоединяется к ним в количестве шести атомов на молекулу, причем образуются гексанафтены (ср. выше). Зато реакции замещения здесь весьма разнообразны. Хлор и бром, например, действуют на ароматические углеводороды на холоде: C6H6+Cl2 = C6H5Cl+HCl. Так же легко реагируют с ними азотная кислота с образованием нитросоединений (см. нитробензол) и серная — с образованием сульфокислот (см.). К окислителям бензол чрезвычайно устойчив, гомологи же его довольно легко окисляются в соответствующие ароматические кислоты, причем действие окислителя всегда направляется на боковую цепь: например, C6H5CH3→C6H5CO2H (бензойная камлота). Всю совокупность подобных химических свойств обыкновенно обозначают как особый «ароматический характер» молекулы. Следует отметить, что таким характером, кроме углеводороды ряда CnH2n-6 обладают углеводороды и некоторых других, высших рядов. Таковы, например, нафталин (ряд CnH2n-12), антрацен (ряд CnH2n-18) и др. Во всех них принимают наличность двух или более бензольных ядер.
Как уже было указано, каждый из углеводородных рядов состоит из группы гомологов. Последние легко выводятся из простейшего углеводорода того или иного ряда путем замещения водородных атомов на метальные группы. Вот, например, начало гомологического ряда олефинов:

Как это видно на примере диметил-этиленов, такое метилирование может приводить иногда к двум углеводородам одинакового молекулярного веса, но различного строения, т. е. к двум (или более) изомерам. Базируя на теории строения, можно таким образом, исходя из простейшего углеводорода того или иного ряда, составить себе представление о всем ряде. Из углеводородов путем замещения легко могут быть выведены все остальные органические соединения. Замещая, например, водородные атомы в углеводородах на гидроксильную (ОН) или карбоксильную (СО2Н) группы, мы получаем соответствующие спирты или кислоты и т. д. Все эти соединения, обладая самыми разнообразными свойствами, сохраняют, однако основной характер (предельный, непредельный, ароматический и т. п.) своего ряда. Можно говорить поэтому не только об углеводородах, но вообще о соединениях парафинового, олефинового и других рядов. Около простейших представителей углеводородов группируется таким образом все разнообразие органических соединений.
С. Наметкин.
| Номер тома | 42 |
| Номер (-а) страницы | 33 |
